*仅供医学专业人士阅读参考
点击右上方“关注”,准时接收每日精彩内容推送。
天然血管由于结构成熟,具有包括弹性、顺应性和优异的抗血栓性能的完整功能。为了替代受损的血管,血管移植物应该通过模拟自然的血管结构来实现这些功能。尽管天然血管的结构已经被彻底研究,但构建与天然血管的机械和生物学特性相匹配的小直径血管移植物仍然是一个挑战。上海工程技术大学朱同贺联合山东第一医科大学第一附属医院王坤和复旦大学徐晨等人通过静电纺丝、编织和热诱导相分离(TIPS)制备了一种分层血管移植物,并将其命名为EBT血管移植物(EBTVG),以模拟自然血管的结构。内部电纺结构促进了内皮细胞的黏附,从而加速了内皮化。中间的聚乳酸-羟基乙酸共聚物(PLGA)织物具有优异的力学性能,这使其在长期移植期间保持其形状,并防止移植物膨胀。外部的大孔结构有利于细胞的生长和渗透。血管重塑的目的是将促进组织再生的结构与抗炎物质结合起来。体外实验结果表明,EBTVG具有良好的力学性能、可靠的细胞相容性和原位内皮化能力。体外和体内移植的结果表明,EBTVG结合了不同的结构优势、生物力学性能和可靠的生物相容性,显著促进了血管内皮细胞(VECs)和血管平滑肌细胞(VSMCs)的稳定再生,稳定了血液微环境。相关研究成果以“Fabric-enhanced Vascular Graft with Hierarchical Structure for Promoting The Regeneration of Vascular Tissue”为题于2024年1月27日发表在《AHM》上。
1. 血管移植物的结构设计及功能
血管移植物的三维结构与血管组织的再生效果密切相关。宿主细胞早期募集移植物可以促进组织形成;因此,高度相互连接的孔结构对细胞渗透非常重要。此外,以前的研究已经认识到,根据移植物的孔结构和孔径来调节炎症反应可以是促进组织重建的有效解决方案。因此,作者设计了一种具有分层结构的小直径血管移植物,其结构模仿了天然血管的三层结构。如图1a所示,采用具有良好强度和弹性的编织管状PLGA织物作为EBTVG的机械支撑。这在植入后的早期阶段作为机械支撑,然后被降解以产生更多的孔洞,促进宿主细胞生长到EBTVG的壁上。内层是一种仿生ECM-电纺聚(酯-阿魏酸-氨酯)尿素(PEFUU)纤维,为内皮细胞的黏附和增殖提供了一个活性部位。外层是蓬松、海绵状的PEFUU基质,具有微孔和柔软、弹性的机械性能,可促进细胞分化和增殖,并分泌细胞外基质,以弥补因材料降解而迅速失去的机械性能。此外,PEFUU基质具有多孔和连通的结构,可以快速动员身体向血管周围组织招募干细胞。更重要的是,这种蓬松的海绵基质可以促进毛细血管通过EBTVG壁渗透到周围组织,并渗透到血管移植物中,促进血管再生,有利于血管内皮细胞的再生。如图1b所示,构建的血管移植物具有与天然血管相似的结构,这些血管具有不同的孔大小,促进内皮细胞和平滑肌细胞的再生。该物质的抗炎作用可促进M2巨噬细胞极化,从而有效促进血管组织再生。
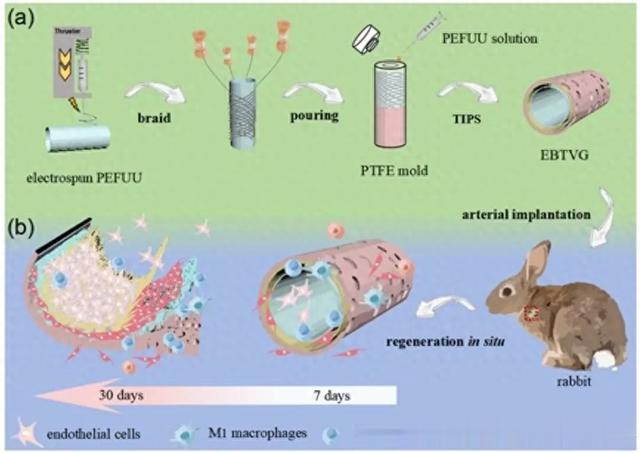
图1 EBTVG血管移植物的制备工艺和体内血管组织潜在的修复机制
2. 血管移植物的形态结构
数码照片显示EVG和EBTVG的表面光滑而平坦,而带有明显的PLGA织物图案的EBVG与PEFUU纤维表现出良好的粘附性(图2a)。扫描电子显微镜图像显示了EBTVG的横截面结构(图2b)。按照预定的设计,所制备的EBTVG具有三层结构,由电纺PEFUU纳米纤维的薄内层、多孔且相互连接的海绵状PEFUU基质的外层和中间蓬松的PLGA织物组成。血管内径为2 mm,管壁厚度为523±23 μm,与自体动脉参数一致。在移植物内部观察到一种多孔性杂合结构,可以模拟天然血管的层次结构。图2c和2d中的EBTVG在扩张-恢复和压缩恢复期间的数字照片显示,EBTVG在压缩和扩张期间具有良好的弹性和形状保持性,并且在收缩期间可以保持其形状。血管移植物的亲水性表面促进蛋白质的吸附,从而促进血管组织细胞在移植物表面的黏附和增殖。相分离和编织层结构有效地改善了其亲水性,这主要是由于孔径和孔隙率的增加以及膨胀率(图2e)。然而,三组移植物的肿胀率均在正常范围内(图2f)。
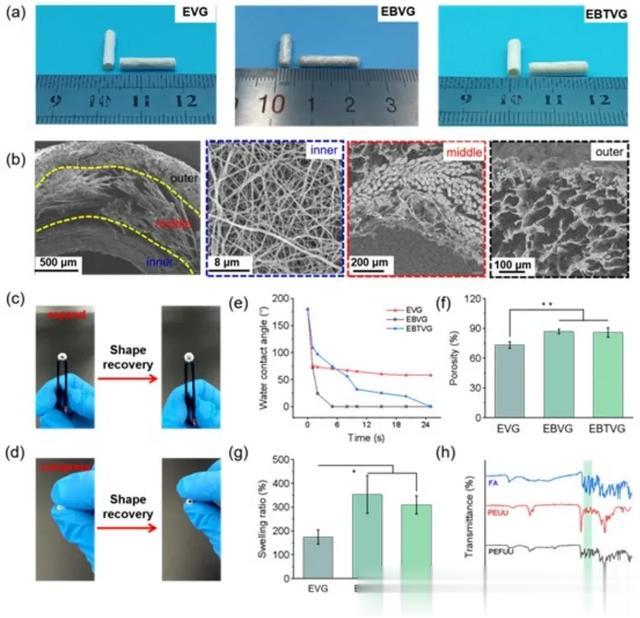
图2 血管移植物的形态结构
3. 血管移植物的机械性能
人工血管的拉伸强度可以抵消血流对血管壁造成的剪切力,是评估其力学性能的重要指标。PLGA织物(EBVG和EBTVG)移植的径向拉伸性能比EVG有很大改善(图3a),表明编织PLGA可以有效地提高EVG的机械支撑能力(图3b)。应力-应变曲线 (图3c)结果表明,EBVG和EBTVG的结构与天然血管相似,具有理想的柔韧性。作者还采用动态力学测试测量人工血管移植物抗疲劳性能。经过10次循环拉伸后,EBVG和EBTVG几乎没有应力损失,归功于编织结构的优异力学性能,但EVG有5.2%的应力损失是由于阿魏酸(FA)的加入,破坏了聚氨酯分子链的规整性,使其难以抵抗长期循环拉伸(图3d)。

图3 血管移植物的力学性能
4. 血管移植物对巨噬细胞极化的影响
CD86是一种共刺激分子,通常被认为是M1巨噬细胞(促炎巨噬细胞)的标志之一。从图4a的荧光染色可以看出,PEUU/FA组和PEFUU组的CD86的荧光强度较弱。与M1相关的蛋白质水平的统计数据也可以有效地证明这一点(图4b)。从图中可以看出,PEUU促进M1细胞极化的程度与空白对照组相同,而PEUU/FA和PEFUU能有效地阻止巨噬细胞极化为促炎症反应的M1表型。其中,PEFUU因其分子量分布更均匀、结构更均匀而具有较好的抗炎作用。图4d显示IL-4和IL-10诱导的巨噬细胞的免疫荧光染色。PEUU/FA组和PEFUU组CD206水平较高,提示FA的加入促进了M2巨噬细胞表型的极化。图4e中巨噬细胞相关蛋白的表达水平也证明了这一点。图4f显示了M2巨噬细胞相关炎症因子的表达水平统计,PEFUU组有更多的M2细胞。M2细胞可以起到抑制炎症的作用,因此其较高的极化水平促进了血管愈合。巨噬细胞实验结果表明,PEFUU作为血管移植材料具有很好的抗炎和抗氧化作用。
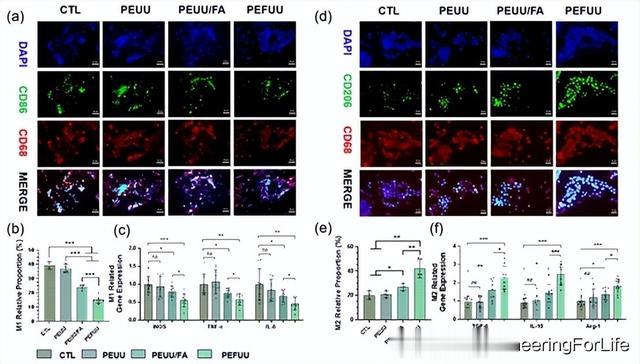
图4 血管移植物对巨噬细胞极化的影响
5. 血管移植物体内组织再生
作者进一步对血管移植物的体内组织再生进行评价。血管的功能重建需要足够的弹性蛋白和胶原沉积来提供机械支持。因此,平滑肌层中的III型胶原含量对功能恢复至关重要。通过对I型胶原、III型胶原的免疫荧光染色(图5a),胶原含量的统计(图5b)验证了I型和III型胶原的含量分别为40%和59%。III型胶原在管腔和外膜呈阳性表达,标记的平滑肌细胞周围的III型胶原含量达到30%以上(图5c)。以上结果证明,EBTVG能使平滑肌转化为更成熟的表型,恢复血管的收缩功能,从而更好地匹配自体血管的力学行为。
植入后的组织重塑与巨噬细胞的行为有关;严重的炎症反应抑制了组织再生。极化的巨噬细胞可分为M1和M2细胞;M1巨噬细胞通常表现出促炎行为,而M2巨噬细胞可以促进组织修复和再生。移植物用炎症标记物染色以评估炎症反应。在图5d中可以看到移植物中有大量CD68标记的巨噬细胞。通过比较血管移植物不同部位的炎症反应,如图5e所示,由于其快速降解,外部大孔结构具有强烈的炎症反应。然而,炎症反应消退,随着FA的释放,表达更多的M2巨噬细胞(图5f)。可见,FA与结构的结合能有效抑制炎症反应,将巨噬细胞转化为促进组织修复的表型(图5g)。

图5 血管移植物的体内组织再生
综上所述,这项研究开发的PLGA纤维增强的PEFUU血管移植物是一种潜在的血管组织重建模型。这种复合结构具有可靠的生物相容性,可以模拟自体血管的力学性能。动物实验结果表明,EBTVGs可促进血管宿主细胞的黏附和增殖,促进血管组织重塑。并且从PEFUU释放的FA赋予EBTVGs持久和增强的抗炎能力,以重塑血管组织。这可能是发展长期通畅性血管移植物的一种替代策略。
了解更多
关注“EngineeringForLife”,了解更多前沿科研资讯~

