*仅供医学专业人士阅读参考
点击右上方“关注”,准时接收每日精彩内容推送。
可注射生物材料因其在微创外科手术和组织再生方面的潜在有益应用而受到越来越多的关注。细胞外基质(ECM)水凝胶和多孔合成聚合物微球可用于注射给药,以实现原位组织再生。然而,细胞外基质水凝胶的快速降解以及大多数聚合物微球较差的可注射性和生物惰性限制了它们的促进再生能力。
来自南开大学的李雯、孔德领和朱美峰团队开发了一种由弹性多孔聚(l-乳酸-co-ε-己内酯)(PLCL)微球与 ECM 水凝胶混合组成的生物材料系统,作为具有白细胞介素-4(IL-4)和胰岛素样生长因子-1(IGF-1)双释放功能的可注射复合材料。所开发的多功能复合材料具有良好的注射性和生物相容性,注入肌肉组织后可调节巨噬细胞和肌原细胞的行为。在雄性大鼠体积性肌肉缺失模型中,植入后 2 个月,新肌肉形成、血管化和神经化均得到增强,这证明了所开发的复合材料对组织再生的促进作用。本研究开发的系统为生物活性可注射复合材料的工程设计提供了一种前景广阔的策略,这种复合材料具有临床使用的理想特性,并具有在多种类型的外科手术中用作微创和促进再生的植入材料的转化潜力。相关工作以题为“Elastic porous microspheres/extracellular matrix hydrogel injectable composites releasing dual bio-factors enable tissue regeneration”的文章发表在2024年02月14日的国际顶级期刊《Nature Communications》。

1. 创新型研究内容
本研究根据先前研究中发现的有利特性,选择了可生物降解的弹性聚(l-内酯-己内酯)(PLCL)来制备 PM。弹性 PLCL PM 采用微流控和聚合物浸出技术相结合的方法合成,然后用多巴胺(PDA)共轭 IGF-1(PM@IGF1)进一步修饰(图 1A)。IL-4 被物理载入猪肌肉源 ECM(mECM)水凝胶(mECM@IL4)中。然后,将 PM@IGF1 微球和 mECM@IL4 水凝胶按最佳比例混合,制成生物活性可注射复合材料(mECM@IL4 + PM@IGF1)(图 1B)。本研究对弹性聚甲基丙烯酸酯、mECM 水凝胶和复合材料的结构、机械和物理特性进行了表征。本研究还关注了 mECM@IL4 + PM@IGF1 的释放行为及其对体外巨噬细胞和成肌细胞的调节作用。最后,本研究通过皮下注射和大鼠胫骨前肌体积损失模型(图 1C)证明了 mECM@IL4 + PM@IGF1 复合材料的可注射性、生物相容性和促进再生效果。

图1 mECM@IL4 + PM@IGF1 复合材料的制备和应用示意图
【弹性多孔微球的制备、多巴胺改性和表征】
本研究采用微流控和明胶浸出相结合的方法制备了 PLCL、聚(乳酸/乙醇酸)(PLGA)和聚(己内酯)(PCL)三种合成聚合物的微球。扫描电子显微镜(SEM)显示,PLCL、PLGA 和 PCL 微球保持了立体球形结构,表面和整个内部具有高度相互连接的孔隙结构(图 2A)。PLCL、PLGA 和 PCL 微球的直径分别为 345.7 ± 42.8 µm、383.5 ± 66.6 µm 和 392.9 ± 65.2 µm(图 2B)。PLCL 微球表面和横截面上的孔直径分别为 48.9 ± 14.3 µm 和 39.3 ± 13.8 µm,没有显著的统计学差异(图 2C)。PLGA 和 PCL 微球的表面孔径分别为 29.7 ± 7.6 µm 和 45.7 ± 9.8 µm(图 2C)。此外,聚多巴胺(PDA)改性不会影响微球的直径和孔径(图 2A-C)。PDA 改性 PLCL 微球(PLCL@PDA;PM)的平均直径为 355.3 ± 37.4 µm,表面和横截面上的平均孔径分别为 45.7 ± 13.3 µm 和 41.3 ± 12.2 µm(图 2B,C)。

图2 多孔合成聚合物微球的制备、多巴胺改性和机械物理特性分析
【mECM 水凝胶和 mECM + PM 复合材料的制备和表征,以及 mECM@IL4 + PM@IGF1 的双释放曲线】
接下来,本研究结合物理、化学和生物处理方法制备了猪 mECM 水凝胶(图 3A)。脱细胞后,肌肉组织变成白色半透明。H&E 和 Masson's trichrome 染色显示保留了 ECM、肌纤维和少量胶原蛋白(图 3B)。脱细胞后,DAPI 染色和相应的统计数据显示,97.9 ± 2.0% 的细胞核被去除。经 DNA 定量试剂盒检测,DNA 含量从 536.2 ± 70.4 纳克/毫克降至 37.5 ± 2.2 纳克/毫克(图 3B、F、G),低于 50 纳克/毫克的含量阈值,而 50 纳克/毫克的含量阈值表明脱细胞充分42。经 α-半乳糖苷酶定量试剂盒检测,α-gal 的活性也从 2689.9 ± 202.7 U/g 降至 287.0 ± 148.9 U/g (图 3H)。接下来,本研究对 mECM 的凝胶形成能力和条件进行了筛选。1% 的 mECM 水凝胶无法形成水凝胶,2% 的 mECM 水凝胶不稳定。3% 的 mECM 可形成稳定的水凝胶,表现出典型的凝胶状外观和形状,用镊子夹取也不会断裂(图 3C,补充图 4)。因此,本研究选择了 3% 的 mECM 来构建复合材料。扫描电镜显示,3% mECM 水凝胶的表面和横截面具有均匀的微孔结构,表面和内部孔径分别为 33.9 ± 11.5 µm 和 63.4 ± 23.2 µm(图 3D)。为了筛选复合材料的最佳浓度,本研究关注了不同的 mECM 与 PM 质量比对复合材料的可注射性、稳定性、力学和促再生效应的影响,并选择 10:1 的质量比用于后续实验。在干燥条件下,微球分布在整个 mECM 水凝胶中,并且通过扫描电镜观察到 mECM 也固定在 PLCL 微球的多孔壁中(图 3D)。在潮湿条件下,罗丹明标记的 PLCL 微球和 FITC 标记的 mECM 水凝胶形成了均匀且相互渗透的复合结构(图 3E)。流变学测试表明,当温度低于 37℃时,mECM 溶液无法形成水凝胶,而微球的初始储存模量(G')约为 40 Pa(图 3I、J、L)。
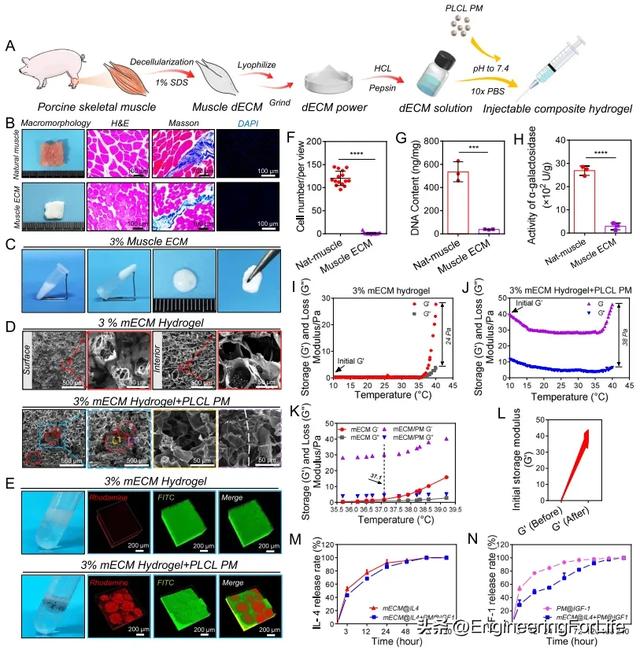
图3 mECM 水凝胶、mECM + PM 复合材料的制备和表征,以及 mECM@IL4 + PM@IGF1 的释放行为
【mECM@IL4+PM@IGF1复合材料可协同诱导原代巨噬细胞极化为促再生表型】
本研究使用经孔共培养实验来评估复合材料对原代骨髓源性巨噬细胞(BMDMs)行为的调节作用(图 4A)。CD68和CD206免疫荧光染色显示,所有IL-4组(mECM@IL4 + PM、mECM@IL4 + PM@IGF1和纯IL-4组)在第1天都会显著增加CD206的表达(图4B)。虽然IL-4组的CD206表达量往往高于mECM@IL4 + PM组和mECM@IL4 + PM@IGF1组,但没有观察到显著差异(图4C)。从第1天到第3天,IL-4组的CD206表达量无明显变化,但其他组的CD206表达量有所增加(图4B,C)。第 3 天,mECM@IL4 + PM@IGF1 组的 CD206 表达高于其他组,与对照组、mECM+PM 组和 mECM + PM@IGF1 组相比有显著差异(图 4B,C)。促再生巨噬细胞主要表现为拉长的细胞形态,而促炎巨噬细胞大多呈圆形(图 4D)。在第 1 天,IL-4 组(mECM@IL4 + PM、mECM@IL4 + PM@IGF1 和 IL-4)BMDM 的伸长值往往高于无 IL-4 组,尽管没有显示出显著差异。然而,与纯IL-4组相比,mECM@IL4 + PM和mECM@IL4 + PM@IGF1组的伸长值无明显差异(图4E)。与第 1 天的测量值相比,含 IL-4 组第 3 天的 BMDMs 延伸值呈上升趋势。在第 3 天,mECM@IL4 + PM 组和 mECM@IL4 + PM@IGF1 组的 BMDMs 延伸值高于纯 IL-4 组,但同样没有显著差异(图 4E)。
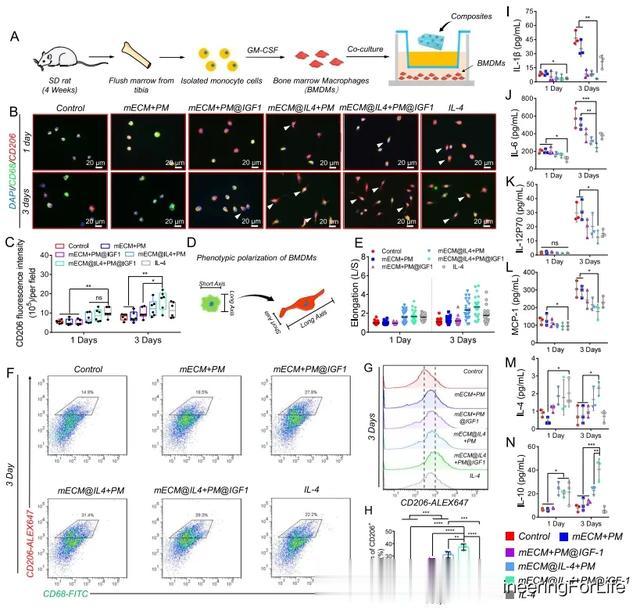
图3 mECM 水凝胶、mECM + PM 复合材料的制备和表征,以及 mECM@IL4 + PM@IGF1 的释放行为
【BMDMs 和复合材料对 L6 细胞和受伤的原始卫星细胞行为的调节作用】
TUNEL染色可用于评估复合材料对L6细胞的抗凋亡作用。在第7天,mECM@IL4 + PM@IGF1组的TUNEL阳性细胞数量低于其他组,这表明与对照组、mECM + PM组和纯IGF-1组相比存在显著差异(图5A, B)。用 CCK8 检测不同处理后 L6 细胞的活力(图 5C)。第 1 天,各组间无显著差异。第 3 天,mECM@IL4 + PM@IGF1 组的细胞活力高于对照组、mECM + PM 组、PM@IGF1 组和 mECM + PM@IGF1 组,低于纯 IGF-1 组,但无统计学差异。第 5 天和第 7 天,mECM@IL4 + PM@IGF1 组的细胞存活率明显高于对照组、mECM + PM 组、PM@IGF1 组和纯 IGF-1 组,与 mECM + PM@IGF1 组相比无显著差异(图 5C)。随后,本研究构建了体外CTX诱导的细胞损伤模型,以研究BMDMs和复合材料对损伤的原代卫星细胞行为的调控作用(图5D)。经 0.3 µM CTX 处理 2.0 ± 0.5 h 后,卫星细胞胞内 Ca2+ 荧光强度增加了 30-40%,表明细胞损伤模型构建成功(图 5E、F)。
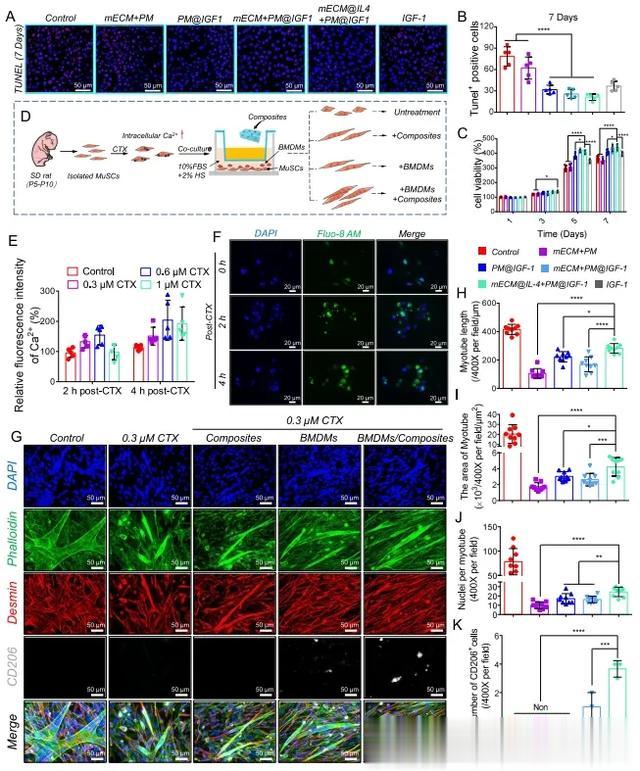
图5 mECM@IL4+PM@IGF1复合材料调节成肌细胞的行为
【复合材料具有高注射性和组织相容性】
本研究使用大鼠皮下注射模型验证了复合材料的注射性能(图 6A)。mECM 水凝胶在注射器中呈乳白色,没有沉积或分离迹象。装入注射器后,PM 组的微球聚集并沉淀在底部。然而,在 mECM + PM 组中,微球与 mECM 水凝胶混合后分散均匀,没有沉淀迹象(图 6B)。在注射过程中,PM 组中单独的微球容易堵塞针头,但 mECM 水凝胶和 mECM + PM 复合物都能顺利注射而不影响流动。注射后,1周后可观察到 mECM 水凝胶、多孔 PLCL 微球和 mECM + PM 复合物。随着植入时间的延长,mECM 水凝胶完全降解,而 PM 组和 mECM + PM 组在第 4 周时仍能检测到微球(图 6B)。H&E 染色显示,宿主细胞大多分布在 mECM 组和 mECM + PM 组材料的外围,而 PM 组的细胞则在第 1 周时迅速渗入微球内部(图 6C)。PM 组的微球在植入 4 周后出现异质降解和塌陷,而 mECM + PM 组的微球则保持了均匀的球形结构,微球之间和微球内部分布着大量细胞和 ECM(图 6C)。微球的短轴/长轴(S/L)值代表微球的变形程度。两组微球的 S/L 值在 1 周时无显著差异,但在 4 周时,mECM + PM 组的 S/L 值明显高于 PM 组(图 6D)。
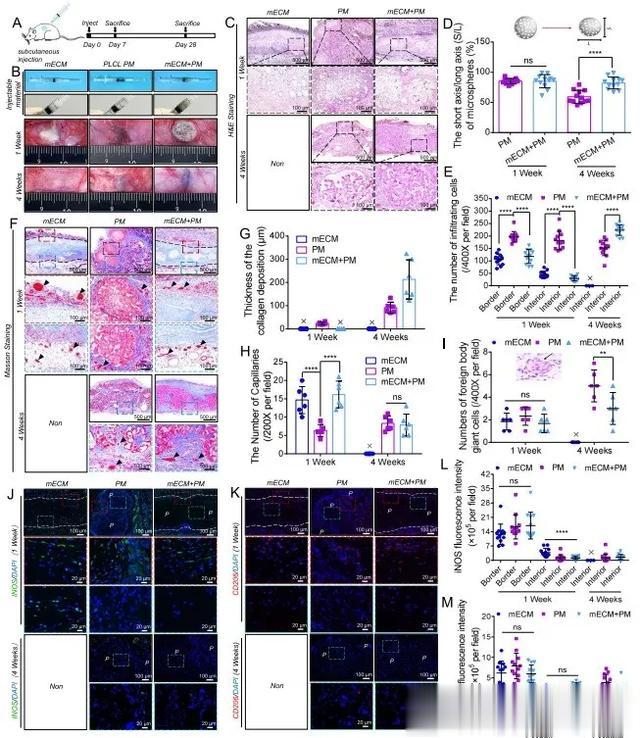
图6 mECM + PM 复合材料的注射性和生物相容性
【mECM@IL4+PM@IGF1复合材料使大鼠模型胫骨前体积性肌肉缺失(VML)后的肌肉再生成为可能】
本研究利用大鼠胫骨前肌体积损失(VML)(40%)模型来评估不同材料的促进再生作用,包括PM、mECM、mECM + PM、mECM@IL4 + PM、mECM + PM@IGF1和mECM@IL4 + PM@IGF1(图7A)。受伤一侧的肌肉体积明显小于正常一侧,在 PM 组、mECM + PM 组、mECM@IL4 + PM 组、mECM + PM@IGF1 组和 mECM@IL4 + PM@IGF1 组中,2 周后仍能观察到注射的微球。此外,所有组别在 8 周时损伤缺损侧的肌肉体积在宏观上都有所增加。8周时,由于再生肌肉组织占据了原来的缺损空间,PM组、mECM + PM组、mECM@IL4 + PM组、mECM + PM@IGF1组和mECM@IL4 + PM@IGF1组中都有一些可见的微球(图 7B)。接下来,我们进行了常规组织学染色和免疫染色以评估肌肉修复的质量,包括 H&E 染色、Masson 三色染色和 desmin 免疫荧光染色(图 7C-E)。
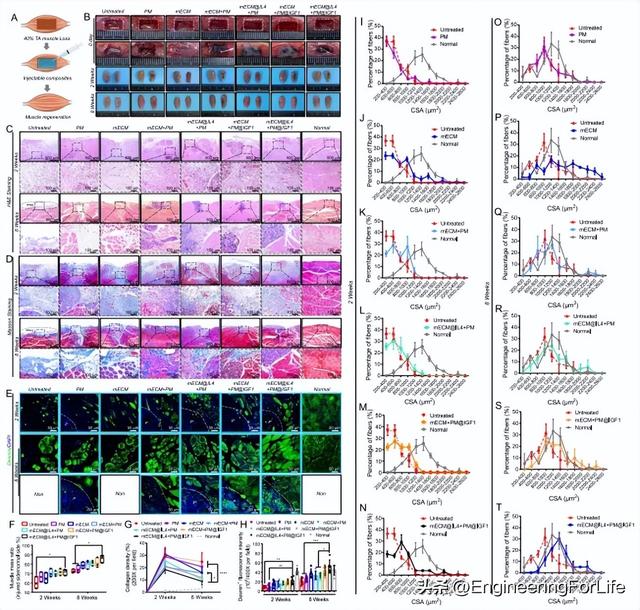
图7 mECM@IL4+PM@IGF1复合材料可在2周和8周后促进体积性肌肉缺失(VML)模型大鼠的肌肉再生
【mECM@IL4 + PM@IGF1 复合材料促进了再生肌肉的血管化和神经化】
血管化和神经化是评估新肌肉组织功能再生的关键指标。本研究首先在 8 周时通过激光多普勒监测植入部位的血流恢复情况。与未处理组相比,植入材料改善了受伤肌肉部位的平均血流灌注。统计结果显示,mECM@IL4 + PM@IGF1 组的平均血流灌注量明显高于未处理组、PM 组、mECM 组、mECM + PM 组和 mECM@IL4 + PM 组,但仍低于正常组(图 8A,B)。用 H&E 染色法评估功能性毛细血管的形成,结果显示毛细血管管腔内有红细胞(图 8C)。植入材料 2 周后,受伤区域的毛细血管浸润明显增加,大部分毛细血管分布在微球之间和水凝胶内部,只有少数分布在微球内部。根据统计分析,mECM@IL4 + PM@IGF1 组的功能毛细血管数量明显高于未处理组、PM 组、mECM 组、mECM + PM 组和 mECM@IL4 + PM 组(图 8C,D)。
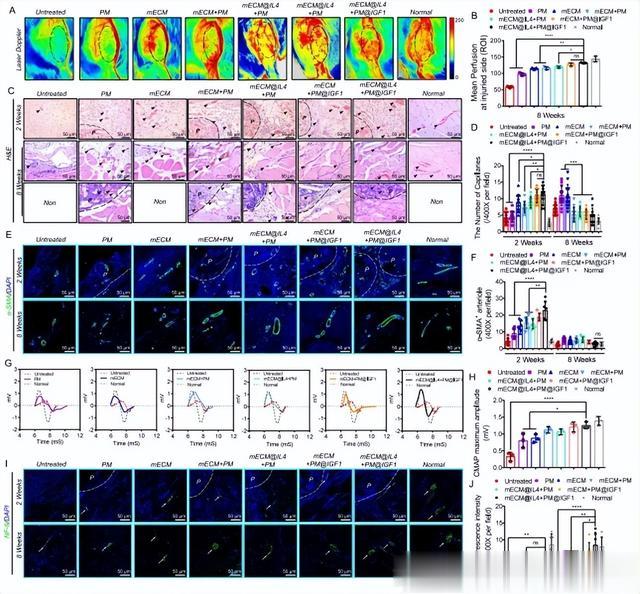
图8 mECM@IL4+PM@IGF1复合材料在2周和8周时促进TA缺损模型大鼠新肌肉的血管化和神经化
【mECM@IL4+PM@IGF1复合材料可切换体内巨噬细胞极化】
最后,本研究评估了复合材料对促炎巨噬细胞和促再生巨噬细胞的数量和分布的影响(图 9)。iNOS+ 作为促炎巨噬细胞的标志物,2 周时在正常组中几乎没有表达,而在其他组中则高表达。mECM@IL4 + PM@IGF1 组 iNOS 的表达低于其他组,与未处理组有显著差异(图 9A,B)。8 周时,各组 iNOS+表达均下降,mECM@IL4 + PM@IGF1 组iNOS+ 细胞数明显低于未处理组、mECM + PM 组和 mECM@IL4 + PM 组(图 9A,B)。2 周时,促炎细胞分泌因子 TNF-α 在 mECM 水凝胶和微球内表达。mECM@IL4 + PM@IGF1 组的 TNF-α+ 表达低于其他组,与未处理组和 PM 组有显著差异。8 周时,各组 TNF-α+ 均明显下降,未处理组仅有少量表达,其他组几乎无表达(图 9C、D)。

图9 mECM@IL4+PM@IGF1复合材料可在2周和8周后调节体内免疫微环境
2. 总结与展望
本研究开发了一种由弹性多孔 PLCL 微球和 mECM 水凝胶组成的可注射复合材料,其中分别负载了 IGF-1 和 IL-4。本研究证明了该复合材料的可注射性和生物相容性,以及促进调节细胞行为和促进内源性组织再生的能力。创新型可注射功能生物材料的开发和应用可提高微创手术的调理效果。大量研究表明,ECM 水凝胶具有很高的生物相容性,但缺乏机械强度且降解迅速。合成聚合物多孔微球可引导组织再生,但其降解副产物容易引发局部炎症反应,限制组织再生。本研究将多孔微球的机械物理和细胞支持特性与 mECM 水凝胶的注射性和生物相容性结合起来,克服了这些缺点。在组织修复过程中,免疫细胞、组织特异性细胞和干细胞/祖细胞相继渗入损伤部位并参与组织重塑。因此,利用生物材料负载的活性因子调节这些细胞行为有望协同促进组织修复。因此,本研究实现了 IL-4 和 IGF-1 的双重释放,以分别共同调节巨噬细胞和组织特异性细胞,实现组织的及时再生。
了解更多
关注“EngineeringForLife”,了解更多前沿科研资讯~

