

将N2直接合成含氮化学物在化学上具有重要意义,但一直面临N2分子惰性和产品范围有限的挑战。为此,福建物质结构研究所王要兵教授(通讯作者)课题组提出了一种级联电合成策略,通过循环Li-N2电池实现N2的还原,并随后转化为各种含氮化学物。
该策略的原型是电合成双(三氟甲烷磺酰基)亚胺锂,通过级联反应实现。这个过程包括电催化N2在放电时还原为Li3N,然后将Li3N酰化为双(三氟甲烷磺酰基)亚胺锂,并最后消除带电的LiCl副产物,完成合成循环。通过扩展衬底范围,这种策略可以直接合成具有不同N-X键(X = S,C等)和金属阳离子(如Li+,Zn2+等)的类似物,并且可以扩大规模以提高能源效率和原子经济性。这项工作为实际生产含氮化学品提供了一种通用的电合成方案,并在可持续化学的更广泛领域具有潜在的影响。这种级联电合成策略为高效合成含氮化学物开辟了新途径,为可持续化学提供了重要的突破。
研究背景
含氮化学品在推动社会进步方面发挥着重要作用,作为农业肥料、医疗保健药品和制造业工业化学品的基本成分得到了应用。传统的氮化工生产依赖于氨(NH3)作为主要中间体,存在几个缺点,包括低活性、低选择性和合成过程中的有害废物排放(如氮氧化物),以及工业NH3生产中的高能耗和碳排放。一种更好的方法是直接转化N2分子,其具有材料丰富、简单、高原子经济性和生态友好性等优点。然而,一个值得注意的障碍是强大的N≡N键(225 kcal mol- 1),它以其抵抗大多数试剂的激活,裂解和并入化学过程而闻名。
图文导读
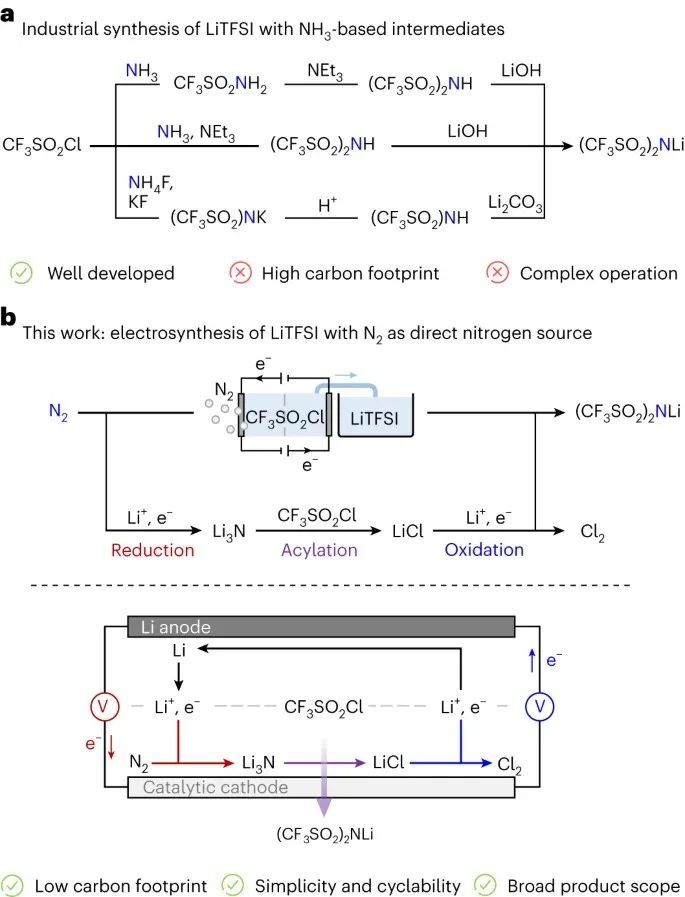
在有价值的含氮化学品中,锂二(三氟甲烷磺酰)亚胺((CF3SO2)2NLi,通常称为LiTFSI)及其类似物作为锂电池和太阳能电池的关键高端电解质脱颖而出。一般来说,目前的热化学合成策略依赖于NH3,并涉及复杂的纯化方法来消除副产物,如LiCl和NH4Cl(图1a )。一种电合成方法,直接结合活化的N2中间体,在更良性的条件下生产LiTFSI将是重要的。
受Li-N2电池概念的启发,该电池利用N2和Li3N之间的相互转化来存储能量,作者提出了一种级联电合成策略,用于电催化N2还原和随后以环方式生产纯化的含N化学物质(图1b)。在原型场景中,电池放电允许将N2(缩写为Re)还原为Li3N (6Li+ + 6e−+ N2→2Li3N; ΔG1 = -135.40 kJ mol-1),与CF3SO2Cl通过自发S-N酰化反应(Ac)生成LiTFSI和LiCl (Li3N + 2CF3SO2Cl→(CF3SO2)2NLi + 2LiCl; ΔG2 = -111.43 kJ mol-1)。LiCl副产物在电池充电过程中被氧化(Ox)消除(LiCl→Li(s) + Cl2(g)); ΔG3 = 814.84 kJ mol-1),从而闭合回路。
这种级联工艺(Re-Ac-Ox)能够连续、纯化的LiTFSI电解质生产,不需要NH3中间体或额外的设备。此外,整个反应在热力学上是有利的(ΔG = ΔG1 + ΔG2 = -246.83 kJ mol-1),在电合成过程中为系统提供额外的电力。值得注意的是,通过使用不同的底物,这种方法具有扩展到各种含N类似物的潜力,进一步突出了其通用的合成用途。
本文以镍基电催化阴极为例,采用Re-Ac-Ox级联法制备了LiTFSI及其含N类似物。结果表明,在优化条件下,N2到Li3N还原效率(FELi3N)达到53.2%,LiTFSI合成效率(EELiTFSI)达到3.0%,功率降低15.8%。Li3N与CF3SO2Cl的酰化产生92%的Li3N到LiTFSI的转化效率,产生48.9%的N2到LiTFSI的转化效率(FELiTFSI)。
此外,作者证明了这种方法对连续流合成的适应性,并将其推广到其他含N-X键的类似物(X = S, C等)和金属阳离子(Li+, Zn2+等)。这种高效、低碳足迹的路线大大拓宽了金属-N2电池的范围,为合成具有增强N原子经济性的高端电解质提供了一条有前途的途径,并在需要富氮化学品的各种应用中具有潜力。
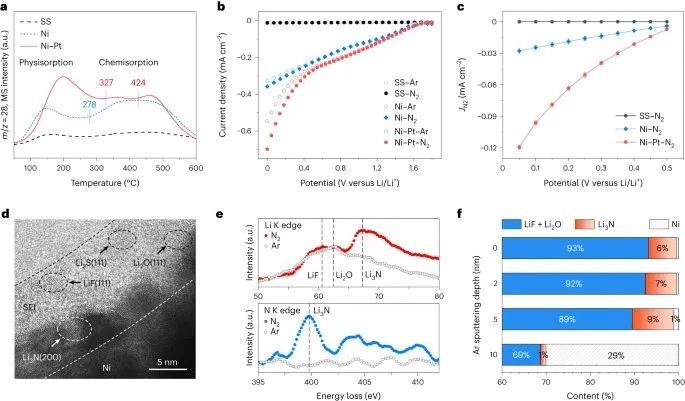
为了研究N2电化学还原为Li3N的过程,选择泡沫镍作为Li-N2电池的阴极模型,并以不锈钢(SS)和Ni-Pt作为对照。通过N2程序升温解吸(TPD)实验初步考察了材料的N2吸附行为,如图2a所示。与Ni相比,SS对N2的吸收最小,在278℃的起始温度下有明显的化学吸收峰。对于Ni-Pt,在327°C和424°C观察到强化峰,表明更高的N2结合能和增强的电还原活性的潜力。
为了进行性能评估,作者采用银(Ag)作为参比电极以及Pt作为对电极,电解液为四氢呋喃(THF)中的1 M三氟甲烷磺酸锂(三氟酸锂,或LiOTf),在充满氩气(Ar)的手套箱中进行。
本研究采用线性扫描伏安法(LSV)考察了Ni、Ni-Pt和SS的N2还原活性。LSV曲线显示,与Li/Li+相比,Ni和Ni-Pt在N2气氛中在0.5至0.05 V的电位范围内的电流密度增加,表明发生了额外的N2还原反应(图2b)。值得注意的是,Ni-Pt的活性比Ni强,这可以通过降低的起始电位(ΔE = ~50 mV)和增加的N2还原分电流密度(图2c)来证明。相反,SS在Ar和N2气氛中均表现出相似的行为和低电流密度,表明其对N2电还原的惰性。
低温透射电镜(cryo-TEM)结合EDS图谱显示,在放电过程中,Ni-Li合金形成了5-10 nm的固体电解质界面(SEI)层(图2d)。此外,Ni和SEI层之间出现了直径约3nm的颗粒,通过局部快速傅里叶变换图像可以识别为Li3N。电子能量损失谱进一步证实了Li3N的存在,在图2e的N K边(E = 399.5 eV)33和Li K边(E = 67.3 eV)34出现了新的峰。在Ar和N2环境中观察到的Li K-edge光谱中E = 61.7 eV和63.1 eV的附加峰对应于SEI层内的LiF和Li2O,与快速傅里叶变换分析很好地吻合。X射线光电子能谱(XPS)深度剖面谱进一步揭示了这一现象。 XPS显示,随着Ar溅射深度从0纳米增加到10纳米,SEI层(主要是LiF和Li2O)逐渐减少(图2f)。
同时,随着溅射深度的增加,Li3N的浓度随着溅射深度的增加而增加,在5 nm处达到9%的峰值,然后在10 nm处下降到1%。在这个阶段,金属Ni出现在Ni 2p光谱中。这揭示了Ni表面化学成分的分布,在0-5 nm范围内以SEI为主,在5-10 nm范围内普遍存在Li3N + SEI组合,与高分辨率冷冻透射电镜观察结果一致。XPS主要分析3-5 nm范围内的表面,因此在蚀刻之前检测到少量的Li3N。
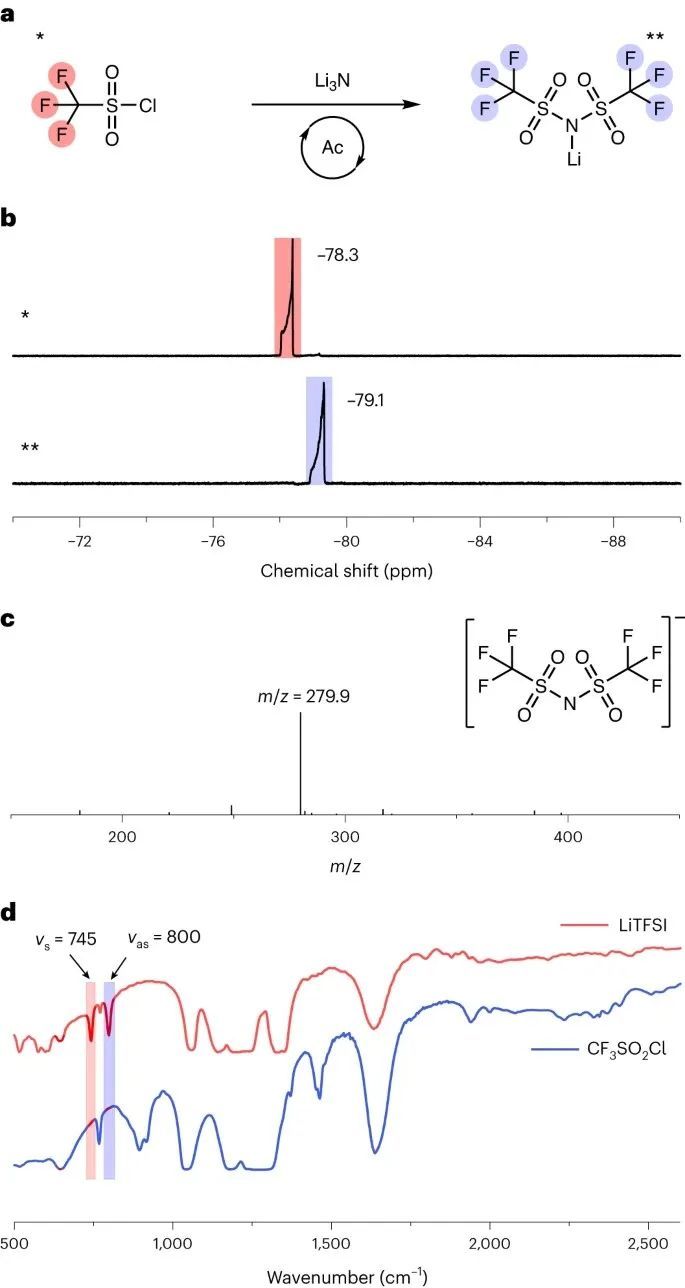
LiTFSI目前是通过NH3或伯胺与活化羧酸的酰化来合成的。或者,Li3N和CF3SO2Cl之间可以发生酰化反应,从而形成LiTFSI(图3a)。在这个反应中,Li3N作为亲核试剂,攻击CF3SO2Cl的亲电碳,CF3SO2Cl被磺酰基的吸电子效应激活。S-N酰化机制可能涉及以下步骤。
首先,Li3N与CF3SO2Cl形成中间络合物,CF3SO2Cl在氮上带正电荷,在氯上带负电荷。接下来,中间络合物发生亲核取代反应,其中氮与碳形成化学键,氯被消除。 为了模拟Li-N2电池实际操作条件下的反应,将Li3N逐渐加入一定量CF3SO2Cl溶解的THF中,并用19F NMR对产物进行了验证。δ = -78.3 ppm处的峰对应于CF3SO2Cl中的氟,其强度随Li3N用量的增加而减小,而在-79.1 ppm处出现一个新的峰,对应于LiTFSI的形成(图3b)。
该反应可由式(1)表示为:2CF3SO2Cl + Li3N = (CF3SO2)2NLi + 2LiCl (1) 。通过添加更多的Li3N,直到CF3SO2Cl峰完全消失,LiTFSI峰达到最大值,发现几乎所有的CF3SO2Cl都转化为LiTFSI。利用质谱(MS)和傅里叶变换红外(FTIR)光谱对LiTFSI的形成进行了表征。TFSI−的质谱在质荷比m/z = 279.9处出现峰值(图3c),而LiTFSI的S-N-S键的对称伸缩振动(νs)和非对称伸缩振动(νas)的FTIR谱在745 cm-1和800 cm-1处出现新的峰值(图3d)。
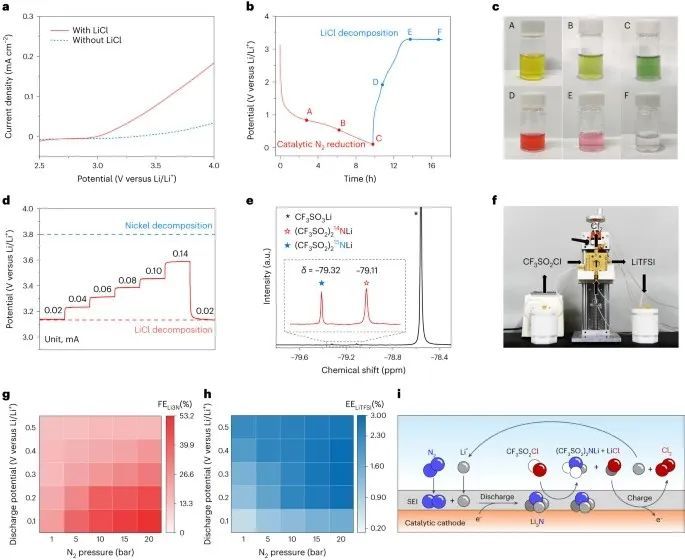
随后,作者研究了以Ni为阴极的锂-N2电池的电合成性能。所选择的电解液为1 M LiOTf/THF,有利于电池正常运行,防止与氮有关的问题,并且不会引起与Li3N的不良反应。在LSV测量中,LiCl的存在大大增加了3.2 V的氧化电流(图4a),在计时电位测量中,电荷平台一致为3.2 V(图4b),表明LiCl氧化。显色反应(图4c)显示,在放电过程中,吲酚蓝由黄色变为绿色(A到C),表明Li3N形成。
同样,甲基橙在充电过程中从红色变为无色(D到F),表明氯化锂氧化释放了Cl2。LiCl分解电压与电流密度的关系如图4d所示。在达到电极分解电压之前,观察到LiCl分解的最高电流(0.14 mA cm-2),确保了纯LiTFSI电解质的快速生产。为了排除错误的结果,作者使用15N2作为氮源来检测产生的15N-LiTFSI。
在本实验中,Li-N2电池在等摩尔的15N2和14N2中放电,其酰化产物通过19F NMR表征。结果显示,在δ = -79.32 ppm处,14N-LiTFSI (-79.11 ppm)的峰值附近出现了一个几乎相同强度的新峰,表明15N-LiTFSI和14N-LiTFSI的产量相等(图4e)。为了证明实际生产LiTFSI的可扩展性,作者组装了一个Li-N2液流电池,如图4f所示。在N2中放电至0.05 V后,CF3SO2Cl从一个罐中泵入反应器,生成LiTFSI和LiCl,在随后的充注中泵回反应器,去除LiCl副产物。当以这种循环方式运行时,Li-N2液流电池在100小时内表现出稳定的性能,并有效地产生纯化的LiTFSI。
此外,通过提高N2压力,Ni-Pt阴极在放电过程中获得了53.2%的最大FELi3N(图4)。 在ηLiTFSI为92%的情况下,在20 bar和0.1 V下,与Li/Li+相比,FELiTFSI最高为48.9%。Ni-Pt的EELiTFSI在3%时达到峰值(图4h),这与LiNR的EE值接近。这些发现证实了作者设计的LiTFSI电合成级联策略的有效性和可行性,并突出了其实际应用的潜力。
为了对表面反应有一个全面的了解,作者再次使用低温透射电镜来阐明表面结构。与CF3SO2Cl缺失的情况相比,不规则结构域的对比度也较低(例如,图2d),这表明CF3SO2Cl与SEI层之间存在潜在的化学或物理相互作用。此外,Li3N纳米颗粒消失,N元素含量明显减少,表明酰化消耗了Li3N。先前对LiNR的研究强调,乙醇可以激活SEI以确保持续的加氢反应生成氨。因此,作者可以预期CF3SO2Cl的潜力,在LiNR中发挥与乙醇类似的作用,激活SEI并使其向内扩散并与Li3N相互作用,最终导致LiTFSI的形成。
基于这一假设,Li-N2电池中LiTFSI的级联电合成过程可以总结如图4i所示。首先,N2分子渗透SEI层并附着在催化阴极上,然后在放电过程中连续添加Li+和e−催化生成Li3N。之后,CF3SO2Cl激活SEI层,增加其渗透性,与Li3N有效相互作用,生成LiTFSI和LiCl。最后,原位生成的LiCl随后在充电过程中氧化为Cl2,同时净化LiTFSI。这种机制途径与热驱动或电催化锂介导的NH3合成不同,因为它独立于金属锂的作用,并且与Li/Li+相比,它在0 V以上的正电位下起作用。这一特点节省了锂沉积和NH3酰化通常所需的能量,是实现节能、高效和原子经济的LiTFSI电合成的关键一步。几种N基有机锂化合物已经在锂电池中找到了潜在的应用。

本研究采用核磁共振和质谱法对电池运行前后的前体和产物进行了比较。在图5a中,4-氟苯磺酰氯(-113.83 ppm)的19F NMR信号在级联反应后大幅下降,同时出现了与LiDFBSI中F元素对应的新峰(-111.35 ppm)。质谱图(图5a)显示了一个属于DFBSI -片段的特征峰,表明氯化物前体成功转化为LiDFBSI。
与LiDFBSI相比,级联电合成策略表明LiTFBSI的转化率和产品纯度更高,这得到了19F NMR(图5b)和质谱(图5b)结果的支撑。这种增强的反应性可归因于三氟甲基(-CF3)基团比氟(-F)基团具有更强的吸电子能力,有利于亲核攻击,促进S-N酰化反应。
文献信息
Zhang, X., Xiong, W., Wang, T. et al. Cascade electrosynthesis of LiTFSI and N-containing analogues via a looped Li–N2 battery. Nat. Catal. (2024).
