*仅供医学专业人士阅读参考


在哥伦比亚西北部的安蒂奥基亚省有一个包含约6000人的大家族,其中超1000人携带早老素蛋白1编码基因PSEN1的E280A突变,该突变携带者几乎100%会患上常染色体显性阿尔茨海默病(ADAD)。在这个家族中,大多数携带者会在40岁中期时出现轻度认知障碍(MCI),40岁后期时发展为痴呆症。
然而,也有例外。2019年时,哈佛医学院领衔的研究团队在《自然·医学》上发表了一个病例报告[1],他们在哥伦比亚家族中发现了一个“改写命运之人”,她虽然携带PSEN1E280A突变,但却在70多岁时才出现MCI,将发病年龄推迟了30年。
经过深入研究,研究人员找到了原因——她同时携带一个极其罕见的纯合基因突变APOE3R136S,研究人员给这个突变取名为Christchurch。体内和死后的检测表明,APOE3Ch突变与tau蛋白积累和神经炎症减少有关,使得携带者虽然有高淀粉样蛋白(Aβ)负荷,但仍有较轻的神经变性和脑淀粉样血管病变。
纯合突变的保护作用对于杂合突变来说是否同样存在?
为了搞清楚这个问题,研究团队在哥伦比亚家族中筛选出了27名同时携带PSEN1E280A和杂合APOE3Ch的成员,他们出现MCI的中位年龄为52岁,而仅携带PSEN1E280A者为47岁,在存在Aβ斑块的情况下,APOE3Ch携带者tau蛋白积累较少,代谢活性相对保留,脑淀粉样血管病理也较少。研究结果发表在《新英格兰医学杂志》上[2]。

在这项回顾性研究中,研究人员对哥伦比亚家族中1077名携带PSEN1E280A者进行了筛选,发现了27名同时携带APOE3Ch的成员,研究人员根据性别、受教育程度和APOE基因型为他们匹配了326名仅携带PSEN1E280A的对照组。
生存分析显示,APOE3Ch携带者发生MCI的中位年龄为52岁,进展为痴呆的中位年龄为54岁,匹配对照分别为47岁和50岁。
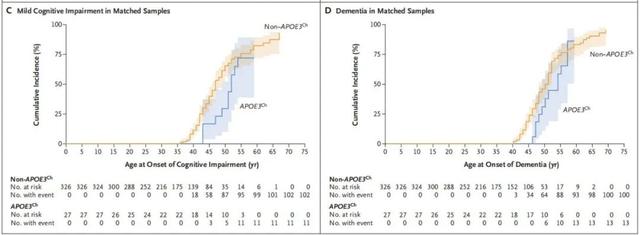
APOE3Ch携带者(蓝)和匹配对照(黄)发生MCI(C)和痴呆症(D)的时间
2名APOE3Ch携带者有较为完整的临床和神经影像学检测结果。其中1名基因型为PSEN1E280A-APOE3Ch/e3,接受过11年的正规教育,47岁时,主客观认知或日常功能检查均没有变化,神经系统检查也是正常的,49岁时报告有轻度的主观记忆下降,51岁时确诊MCI,语义流畅性、执行功能和记忆回忆能力下降,54岁时确诊为轻度痴呆症。
他在51岁时PET成像显示,大脑Aβ负荷略高于匹配对照,但是与AD有关大脑区域中的tau负荷较少,53岁时的FDG PET成像显示,大脑楔前叶葡萄糖代谢率与较为年轻的、在预期年龄时发生MCI的匹配对照在同一范围内。

Aβ和tau PET结果
另一名携带者的基因型为PSEN1E280A-APOE3Ch/e2,未接受过正规教育,42岁时报告了主观认知下降,但整体的客观认知评估结果处于同龄和同受教育水平的正常范围内,语言和非语言测试结果与之前相似,没有明显的功能减退,直至52岁时,出现言语记忆能力下降,尽管保持了功能独立性,但对认知下降的担忧增加,此时,该携带者符合MCI的诊断标准,57岁时确诊轻度痴呆症,62岁时发展为中度痴呆症。
64岁时的FDG PET成像显示,与在预期年龄时发生MCI的匹配对照相比,大脑楔前叶葡萄糖代谢率仍有程度相当的保留。由于当地缺乏条件和美国的旅游禁令,未能接受tau和Aβ成像。
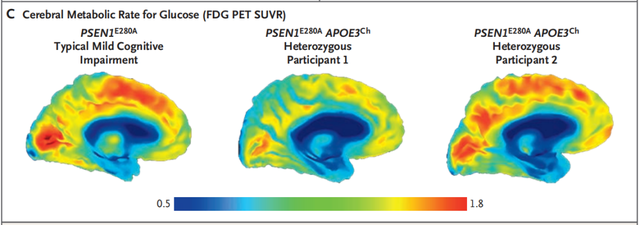
FDG PET结果
4名APOE3Ch携带者有可用的尸检材料,他们相比匹配对照也有较高的Aβ负荷和较低的tau负荷,Aβ和tau的大脑分布模式符合AD患者的典型特征。携带者的额叶皮质中脑淀粉样血管病变的病理表现不明显,且血管壁部分被累及的比例较低。
此前病例报告中的那名APOE3Ch纯合子突变携带者的脑淀粉样血管病变比本队列中杂合子的少,但研究人员指出,这样的直接对比是不合适的,因为那名纯合子携带者比本队列中的杂合子携带者的年龄大得多。此外,相比匹配对照,二者的血管在长度、分支模式和间隔方面相似度更高。
综上,这项研究通过临床、认知、神经成像和神经病理学方面的证据表明,APOE3Ch杂合子也可以一定程度上推迟ADAD相关认知障碍的发生,并且针对AD和神经退行性病变表现出保护作用。
研究人员表示,他们的研究目前仍然样本量较小,且局限于一个家族,未来,更大的、种族更加多样化的样本将帮助进一步阐明Christchurch突变的保护作用,以及确定其是否能够有利于治疗散发型AD。
参考文献:
[1] Arboleda-Velasquez J F, Lopera F, O’Hare M, et al. Resistance to autosomal dominant Alzheimer’s disease in an APOE3 Christchurch homozygote: a case report[J]. Nature medicine, 2019, 25(11): 1680-1683.
[2] Y.T. Quiroz, D. Aguillon, D.C. Aguirre-Acevedo, et al. APOE3 Christchurch Heterozygosity and Autosomal Dominant Alzheimer’s Disease[J]. New England Journal of Medicine, 2024, 390: 2156-2164.
本文作者丨应雨妍
