氟化钠概述
氟化钠(NaF)是一种无机化合物,由钠(Na)和氟(F)元素组成,化学式为NaF。它是氟化物中常见且重要的化学物质,广泛应用于多个领域,尤其在工业和医疗中具有重要的作用。作为一种无色或白色结晶或粉末,氟化钠在许多化学反应中发挥着催化剂和反应介质的作用,同时也在水处理、氟化合物的合成以及牙科治疗中得到广泛应用。

1. 基本属性
氟化钠作为一种常见的无机化合物,具有以下主要物理和化学性质:
氟化钠名称
中文名: 氟化钠
英文名: sodium fluoride
CAS号: 7681-49-4
氟化钠物理化学性质
密度: 1.02 g/mL at 20 °C
沸点: 1700 °C
熔点: 993 °C(lit.)
分子式: FNa
分子量: 41.98820
闪点: 1704°C
精确质量: 41.98820
外观性状: 白色无气味的粉末或晶体
蒸汽压: 1.4 mm Hg ( 0 °C)
折射率: 1.336

储存条件
储存注意事项储存于阴凉、干燥、通风良好的库房。库温不超过35℃,相对湿度不超过80%。包装密封。应与酸类、食用化学品分开存放,切忌混储。储区应备有合适的材料收容泄漏物。
稳定性
1.有毒,有腐蚀性。在100g水中的溶解度为4.0g(15℃),5.0g(100℃),不溶于乙醇。在水溶液中部分水解,故水溶液显碱性,饱和溶液的pH值为7.4。
2.稳定性 稳定
3.禁配物 强酸
4.聚合危害 不聚合
水溶解性 4 g/100 mL (25 ºC)
2. 主要用途
氟化钠因其独特的化学性质,广泛应用于工业、农业、环境保护和医疗等领域。以下是其主要用途:
2.1 水处理
氟化钠常用于水处理,特别是在饮用水氟化过程中。通过向自来水中添加氟化钠,可以有效地减少蛀牙的发生。这种氟化水的应用在全球范围内得到广泛推广,尤其是在一些水源中天然氟含量不足的地区。
2.2 牙科保健
氟化钠是牙科治疗中常用的氟源之一。通过涂抹氟化钠溶液,能够有效预防蛀牙的形成。氟化钠通过形成一层保护性氟化物层,增强牙齿的抗酸能力,抑制细菌对牙釉质的腐蚀,从而起到抗龋齿作用。
2.3 金属表面处理
在金属加工行业,氟化钠常被用于金属表面的处理,尤其是铝的表面处理。氟化钠可以用来生成氟化铝保护膜,增加金属的抗腐蚀性,延长其使用寿命。它也用于铝的熔融过程中,降低熔点和改善铝的流动性。
2.4 农业应用
氟化钠可用作某些农药的原料,尤其是氟化物农药的合成。其氟化基团具有较强的生物活性,可以对植物和害虫产生影响。氟化钠也可用于土壤的酸碱调节,但由于其氟离子的毒性,使用时需要非常小心。
2.5 氟化合物的合成
氟化钠在有机和无机合成中具有重要作用。它常用作合成氟化氢(HF)、氟化铝(AlF₃)等氟化物的重要原料。此外,氟化钠也用于合成一些氟代有机化合物,广泛应用于制药、农药和材料科学领域。
2.6 制冷剂和清洁剂
氟化钠还可作为某些工业制冷剂的原料,尤其是在冷却设备和空调系统中。此外,氟化钠还被用作某些清洁剂的成分之一,尤其是在电子设备制造和金属加工的清洗过程中,具有良好的清洁作用。
3. 合成路线
氟化钠的合成方法相对简单,主要通过以下两种途径进行:
3.1 氯化钠与氟化氢反应
氟化钠的最常见合成方法是利用氯化钠(NaCl)与氟化氢(HF)气体进行反应。该反应在高温下进行,反应产物为氟化钠和氯化氢气体。
这种方法通常在工业中规模化生产氟化钠。
3.2 钠与氟气反应
另一种合成氟化钠的方法是通过钠金属与氟气(F₂)直接反应。在氟气的作用下,钠与氟发生化学反应,生成氟化钠。
此方法较为直接,但由于氟气的反应性较强,需要在严格控制的条件下进行。
制备方法
1、氟硅酸纯碱法a、两步法第1步,用NH4HCO3和H2SiF6反应生成NH4F溶液和SiO2沉淀.反应式如下:H2SiF6+6NH4HCO3→SiO2+6NH4F+6CO2↑+H2O第2步,用Na2CO3与NH4F溶液反应制备NaF反应式如下:2NH4F+Na2CO3→2NaF+(NH4)2CO3b、一步法由氟硅酸一步生产氟化钠的工艺流程如下:反应式如下:


H2SiF6(l)+3Na2CO3(l)+(x-1)H2O(l)→SiO2•xH2O(s)+6NaF(s)+3CO2(g)具体工艺为:反应原料纯碱和氟硅酸摩尔比为n(Na2CO3)/n(H2SiF6)=6.0,反应温度为90~95℃,反应时间为90~120min,溶液pH为5.0~5.5。该工艺生产的产品外观好,质量也好。原料多采用磷肥厂的副产品氟硅酸钠,价格较低并容易购得。生产过程化学反应温和,设备的腐蚀问题较前几种方法要小得多。工艺条件控制得好时,二氧化硅质量接近白炭黑,可作为低档次的白炭黑出售。“三废”排放方面,除了有二氧化碳气体逸出,无其他废水和固废排出,属环境友好型的生产工艺。该工艺也是目前国内生产氟化钠的主要工艺。
2、氟化铵纯碱法
将纯碱和氟化铵分别溶解后按比例混合,并将混合物加热,升温至300℃,搅拌,直到把氨除尽为止。其反应式如下:Na2CO3+2NH4F→2NaF+CO2↑+2NH3↑该工艺优点是工艺简单,最大缺点就是生产成本太高,目前氟化铵的价格远高于氟化钠。
3、熔浸法
该法是氟化钠最早的生产方法。即将萤石、纯碱和石英砂在高温下(~900℃)煅烧,然后用水浸取,再经蒸发、结晶、干燥后即得成品。化学反应式:CaF2+Na2CO3+SiO2→NaF+CaSiO3+CO2↑该法的工艺流程示意如下:
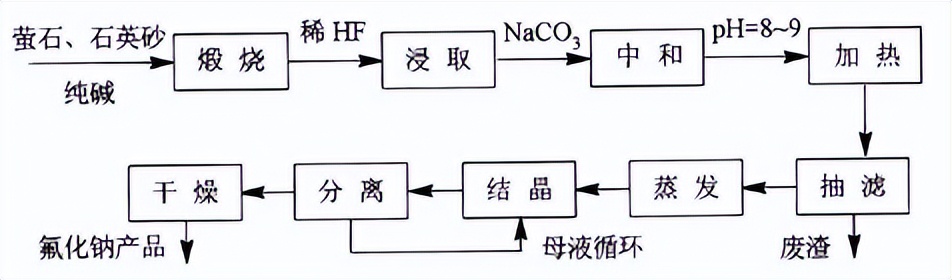
此工艺对原料要求低,原料价格便宜。但产品的生产成本却不低,主要原因是该工艺有以下缺点:1)是物料反应不完全,收率不高;2)氟化钠在水中的溶解度很小,且随温度变化不大,导致浸取率很低;3)煅烧温度高,造成烧结块坚硬,不易粉碎,也造成浸取困难;4)能耗太高,导致生产成本居高不下;5)生产过程环境污染较大。该法已基本淘汰。
4、氢氟酸中和法
氢氟酸中和法是用纯碱或烧碱中和氢氟酸制得氟化钠。生产过程是:向铅制反应釜中加入质量分数40%的氢氟酸,再慢慢加入纯碱或烧碱液中和,直到反应液呈中性为止。然后经结晶、离心脱水、烘干,即得产品。反应式为:Na2CO3+2HF→2NaF+H2O+CO2↑工艺流程如下:
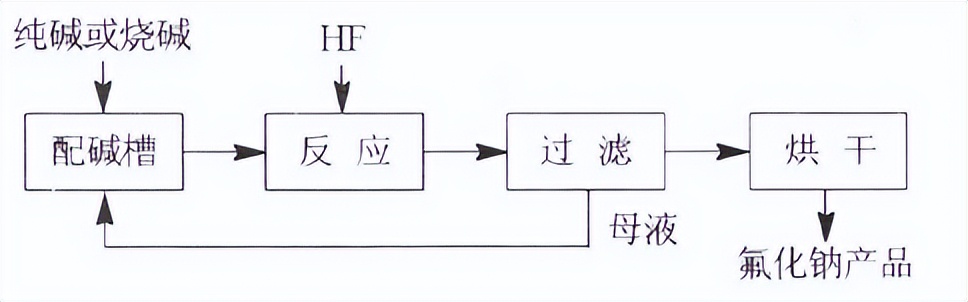
中和法也是较常采用的方法,是一条较成熟的工艺。流程简单、产品质量稳定。但存在设备腐蚀严重的问题,因此对设备材质的要求很高。中和法使用氢氟酸或氟化氢做原料,生产成本较高,在现阶段已缺乏市场竞争力。
5、离子交换法
用氢氟酸处理钠离子交换柱,制取氟化钠。
6、氟硅酸改进方法:
(1)铵化反应碳酸氢铵和氟硅酸反应生成NH4F溶液和SiO2沉淀。反应式如下:H2SiF6+6NH4HCO3→6NH4F+SiO2↓+6CO2↑+4H2OSiO2经洗涤、干燥得白炭黑副产品;NH4F溶液用于制氟化钠。(2)制NaF由NH4F溶液制NaF有两种方法:一是用碳酸钠与NH4F反应,即氟化铵纯碱法;二是用氯化钠与NH4F反应,可称为氟化铵食盐法。两种方法的反应式如下:2NH4F+Na2CO3→2NaF+(NH4)2CO3NH4F+NaCl→NaF+NH4Cl
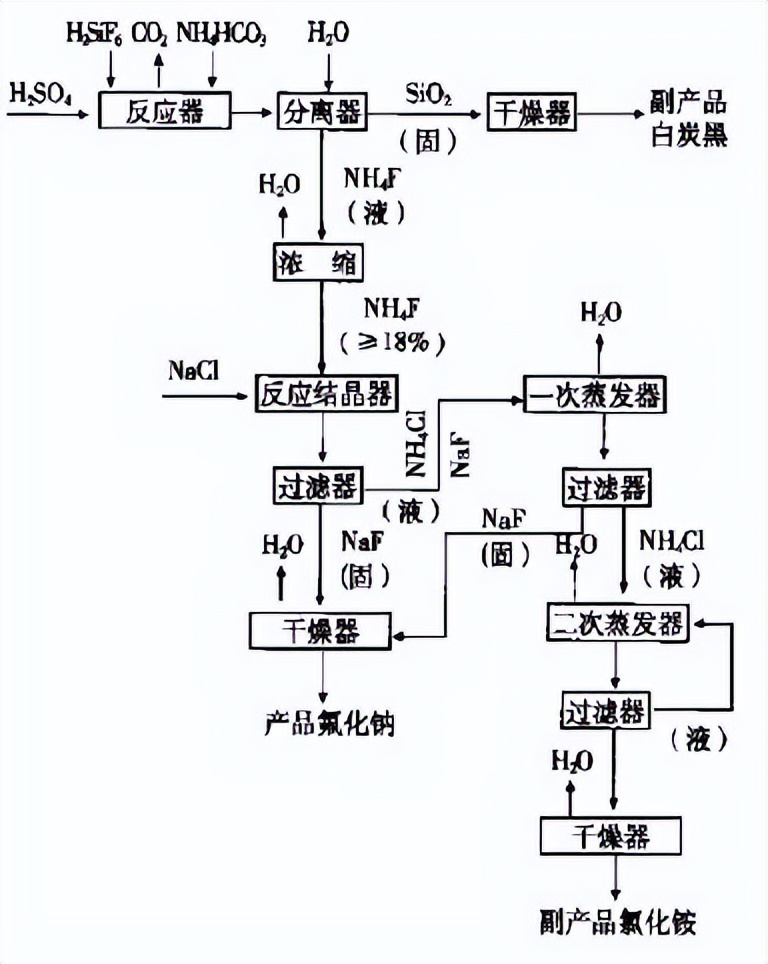
制取工艺流程如下:
7、磷肥副产氟硅酸氨化法
该技术无污染,清洁工艺生产,工艺水全循环,适合磷肥厂含氟尾气处理后生产氟化钠产品。其化学反应式如下:H2SiF6+6NH3+2H2O→6NH4F+SiO2↓,NH4F+NaOH→NaF↓+NH3+H2O。
4. 使用注意事项
尽管氟化钠在许多领域具有广泛应用,但由于其化学性质,使用时需要特别小心:
4.1 健康安全
氟化钠具有毒性,尤其在摄入过量时,可能引起中毒反应。长期接触氟化钠会导致氟中毒,症状包括骨骼损伤、牙齿氟斑病等。因此,在使用氟化钠时,应佩戴适当的个人防护设备,如防护手套、护目镜和口罩。
4.2 环境安全
氟化钠对环境有一定的危害,特别是在水源中。氟化钠进入水体后,可能对水生生物造成毒性影响。因此,氟化钠的排放和处理需要严格遵守环境保护法规,避免污染水源和土壤。
4.3 用量控制
在水处理和牙科应用中,氟化钠的用量需要严格控制。过量的氟化钠可能导致不良健康效应,如氟中毒或氟斑牙。因此,在使用氟化钠时,应根据专业建议和标准进行适当的剂量控制。
5. 运输与存储
5.1 运输要求
氟化钠在运输过程中应按照危险化学品的规定进行处理。运输包装应密封良好,避免漏洒。氟化钠应存放在干燥、通风、阴凉的地方,远离火源和热源。在运输途中,要避免与酸类物质接触,防止发生化学反应。
5.2 存储条件
氟化钠应存储在密封的塑料或玻璃容器中,并放置在干燥、阴凉、通风良好的仓库。氟化钠应远离酸、氧化剂和易燃物品,以避免发生危险反应。仓库应避免阳光直射,且储存区域应远离饮用水源、食物和儿童。

6. 总结
氟化钠是一种用途广泛、化学性质活泼的无机化合物。它在水处理、牙科保健、金属表面处理、农业及氟化合物合成等领域都有重要应用。氟化钠的合成方法相对简单,主要通过氯化钠与氟化氢反应或钠与氟气反应来获得。尽管氟化钠具有重要的工业价值,但在使用、储存和运输过程中需要严格遵守安全规定,以避免对健康和环境造成潜在危害。
通过合理控制使用和处理,氟化钠能够为各行业提供有力支持,同时也需采取必要的安全措施来确保其使用的安全性。
