编者按:乙肝病毒(HBV)相关肝细胞癌(HCC)是我国公共健康领域面临的重要挑战,绝大多数HCC患者诊断时已至中晚期。HBV相关HCC患者术后生存期往往更差。因此,HBV相关HCC的防治亟需全程管理。其中,中国乙肝的一级预防已经取得了卓越的成果。高风险人群应定期筛查,尽早治疗,降低HCC病死率。抗病毒治疗是HBV相关HCC二级预防和三级预防的重要措施。在近期举行的2024年世界肝炎日宣传大会暨消除肝炎危害行动大会上,西安交通大学第一附属医院何英利教授在主题报告中,分享了从肝癌的全程管理看慢性乙型肝炎(CHB)患者抗病毒治疗策略。
 NUC药物在HBV相关HCC二级预防中的作用
NUC药物在HBV相关HCC二级预防中的作用HBV/丙型肝炎病毒(HCV)慢性感染是发生HCC的重要病因。HBV相关HCC二级预防的目标是对于HBV慢性感染者减少或延缓HCC发生。通过抗病毒治疗将CHB患者体内的HBV复制抑制至最低水平或达到功能性治愈,将慢性丙型肝炎(CHC)患者体内的HCV清除以达到治愈,均可明显减少HCC发生,是HBV/HCV相关HCC二级预防最有效的手段[1]。
肝硬化和高病毒载量是HCC的主要危险因素,HCC家族史、饮酒、吸烟、糖尿病等是HCC发生的促进因素。基于患者HCC家族史、HBsAg定量和HBV DNA水平、HBeAg状态等建立REACH-B、mPAGE-B、mREACH-B及aMAP等预测模型,可协助计算亚洲CHB患者未来进展到HCC的风险比。抗病毒治疗与HBV DNA、HBeAg、HBsAg等危险因素的控制直接相关[1]。
HBV DNA>20 IU/mL影响后续治疗的病毒学应答。一项中国香港回顾性队列研究纳入了440例2009年9月及之前的ETV初治CHB患者,对其中治疗12个月应答不佳的患者继续原方案治疗,每3-6个月进行定期随访,至少每6个月进行血清HBV DNA检测,平均随访34±9个月,研究治疗期间HBV DNA水平对ETV反应的预测价值,结果发现,3年的累积病毒学抑制率仅为57.5%,显著低于12个月应答良好的患者(P<0.001)[2](图1)。
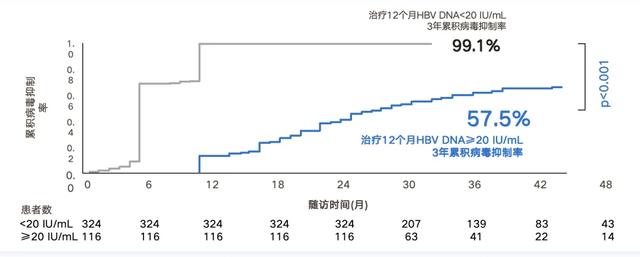
图1. HBV DNA>20 IU/mL影响后续治疗的病毒学应答 (引自讲者幻灯)
规范核苷(酸)类似物(NUC)治疗中病毒阴转的检测值(20 IU/L),可显著降低疾病进展风险。中国香港地区回顾性队列研究纳入2005-2016年期间接受ETV和(或)TDF治疗至少6个月的20263例CHB患者,随访至患者死亡、诊断为HCC、末次随访日期或随访8年,评估NUC治疗结果与HCC和肝脏事件风险之间的关系。主要研究终点为HCC,次要研究终点为肝脏事件和肝脏相关死亡率。结果显示,HBV DNA控制在20 IU/mL以下显著降低HCC风险和肝脏相关死亡风险[3](图2)。

图2. 规范NUC治疗中病毒阴转的检测值(20 IU/L),可显著降低疾病进展风险 (引自讲者幻灯)
NUC治疗可明显降低肝硬化患者HCC发生风险。一项回顾性队列研究分析了两组CHB肝硬化患者。肝硬化定义:肝组织学,血小板减少(<150×109/L)或影像学观察到门静脉高压特征。TDF组包括两组来自亚洲中心至少接受12个月TDF 300 mg/d治疗的持续发病患者,对照组包括只接受日常临床护理的初治患者,比较两组HCC 5年累积发生率,总死亡率和肝脏相关性死亡率。结果显示,未接受任何抗病毒治疗患者HCC的5年累积发生率是26.4%,而接受NUC治疗5年后HCC的5年累积发生率显著降低,仅为13.5%[4](图3)。

图3. NUC治疗可明显降低肝硬化患者HCC发生风险 (引自讲者幻灯)
一项中国研究纳入1453例在中国大陆9家医院接受ETV或TDF治疗≥12个月的HBV相关代偿期肝硬化初治患者,其中TDF组和ETV组分别有188例和1265例患者。主要终点是HCC发生率,次要终点是肝移植率和死亡率,结果显示,中国CHB患者中TDF降低HCC风险优于ETV,特别是在肝硬化患者中[5](图4)。

图4. TDF降低HCC风险优于ETV,特别是在肝硬化患者中 (引自讲者幻灯)
有学者检索2019年后发表的在亚洲地区进行、患者例数超过500例、期刊影响因子高于4分、比较ETV与TDF治疗CHB患者HCC发生率的队列研究,显示亚洲地区更多研究支持TDF降低HCC发生率优于ETV[6](表1)。

表1. 亚洲地区TDF与ETV降低HCC发生率的文献检索结果
TDF可通过抑制Akt磷酸化发挥降低HCC风险和免疫调节作用。TDF的细胞代谢产物可与Akt结合,抑制Akt向质膜的移位,进而抑制其在LPS刺激下的磷酸化,从而抑制LPS介导的IL-10的产生。ADV和TDF可能通过抑制Akt的磷酸化来降低HCC风险,并通过抑制上调IL-12与抑制IL-10作用对HBV发挥良好的免疫调节作用[7](图5)。

图5.ADV/TDF对HBV感染者的潜在价值 (引自讲者幻灯)
一项动物研究提示:TDF可通过下调PI3K/Akt/mTOR信号通路诱导肝星状细胞凋亡直接改善肝纤维化,TDF治疗后PI3K/Akt/mTOR磷酸化水平持续且显著降低,而使用ETV治疗无显著影响[8](图6)。

图6. TDF可通过下调PI3K/Akt/mTOR信号通路诱导肝星状细胞凋亡直接改善肝纤维化 (引自讲者幻灯)
NUC药物在HBV相关HCC三级预防中的作用HBV相关HCC三级预防的目标为:对于HBV相关HCC患者,减少HCC复发,保障HCC综合治疗效果,延长患者生存期。抗病毒治疗是HBV/HCV相关HCC发生后有效的基础治疗措施之一,可减轻肝炎病毒对肝脏的损害,减轻甚至逆转肝纤维化或肝硬化,延缓肿瘤病情进展,减少HCC复发,保护肝功能,保障其他综合治疗效果,提高总生存率,是三级预防的重要手段之一[1]。
NUC药物对HBV相关HCC患者术后复发的影响不同。来自韩国的历史性队列研究连续性纳入1695例接受根治性肝切除术的HBV相关HCC患者,接受ETV或TDF治疗(2010-2018年),结果显示ETV或TDF治疗对HBV相关HCC患者术后复发的影响不同[9](图7)。

图7. NUC药物对HBV相关HCC患者术后复发的影响 (引自讲者幻灯)
一项回顾分析采用台湾大学医院综合医学数据库,纳入390例于1986至2020年的20岁以上在HCC根除性治疗期间至少接受ETV或TDF治疗3个月的CHB患者,中位随访29个月。比较了ETV和TDF在根治性治疗患者中的HCC复发风险和死亡风险方面的差异,结果显示,与ETV相比,接受TDF治疗在HBV相关根治性肝切除术后的复发和死亡风险显著更低[10](图8)。

图8.接受TDF治疗在HBV相关根治性肝切除术后的复发和死亡风险显著更低 (引自讲者幻灯)
一项荟萃分析在MEDLINE、EMBASE、CENTRAL、Science Direct中检索,最终纳入了9项研究,共5298例患者。旨在评估接受ETV和TDF对HBV相关HCC根治性治疗后的复发率和死亡率的影响。与ETV相比,接受TDF治疗在HBV相关肝切除或消融术后的复发和死亡风险显著更低[11](图9)。

图9. ETV和TDF治疗后HCC复发风险与死亡风险 (引自讲者幻灯)
小 结我国HBV相关HCC问题仍面临严峻形势,亟需基于一级、二级和三级防治的全程管理策略。一级预防方面,新生儿实施乙肝免疫后,显著降低了HBV相关HCC的发病和死亡风险。二级预防方面,及时启动抗病毒治疗并规范NUC治疗中病毒阴转的检测值以降低疾病进展风险。三级预防方面,核苷酸类药物在减少HCC复发和改善生存率方面显著更优。
核苷酸类药物TDF具有独特免疫调节机制,可改善肝纤维化,降低HCC发生风险。TDF可通过抑制Akt磷酸化及下调PI3K/Akt/mTOR信号通路机制发挥免疫调节作用,相比ETV,TDF治疗可显著降低患者HCC风险,特别是在肝硬化患者中。与ETV相比,接受TDF治疗在HBV相关肝切除或消融术后的复发和死亡风险显著更低。
参考文献:
1. 中华医学会肝病学分会肝癌学组. HBV/HCV相关肝细胞癌抗病毒治疗专家共识(2021年更新版). 临床肝胆病杂志. 2021;37(10):2292-2302.
2. Wong GL, et al. Aliment Pharmacol Ther 2012;35:1326–1335.
3. Yip TC, et al. J Hepatol. 2019 Mar;70(3)361-370.
4. Ken Liu, Jonggi Choi, Vincent Wai-Sun Wong, et al. Tenofovir treatment reduces hepatocellular carcinoma and deaths in chronic hepatits B patients with liver cirrhosis. APASL 2017 abstract OP115
5. Huang Y, Chen L, Huang R, et al. Tenofovir is superior to entecavir in reducing HCC for patients with HBV-related compensated cirrhosis at high HCC risk scores. Ther Adv Chronic Dis. 2022 Jun 21;13:20406223221102791.
6. Murata K, et al. Immunomodulatory Mechanism of Acyclic Nucleoside Phosphates in Treatment of Hepatitis B Virus Infection. Hepatology. 2020 May;71(5):1533-1545.
7. Lee SW, et al. Tenofovir disoproxil fumarate directly ameliorates liver fibrosis by inducing hepatic stellate cell apoptosis via downregulation of PI3K/Akt/mTOR signaling pathway. PLoS One. 2021 Dec 8;16(12):e0261067.
8. Choi J, et al. Hepatology. doi:10.1002/HEP.31289
9. Choi J, et al. EASL 2020. AS0941
10. Chang KC, et al. J Formos Med Assoc. 2024 Feb 28:S0929-6646(24)00111
11. Giri S, et al. Tenofovir versus entecavir for tertiary prevention of hepatocellular carcinoma in chronic hepatitis B infection after curative therapy: A systematic review and meta-analysis. J Viral Hepat. 2023 Feb;30(2):108-115.
