随着经济的发展,全球对能源的需求不断增长,由此引发了能源和环境问题日益严重。当前的中国能源分布状况是“由于资源有限,分布状况欠佳;浪费巨大,需求量也大;
结构畸形,环境恶化”。我国煤炭人均值、石油人均值和天然气人均值分别约为世界水平的50%,10%和5%,这项数据揭露了我国能源分布不均、资源日益减少等问题,
由于塑料泛滥使用导致“白色污染”问题越来越严峻。每年有八百万吨塑料被丢入海洋,预计再过30年,海洋中的塑料污染物将超过鱼类。
尽管回收越来越普遍,但仍有三分之一的塑料污染物因太小或太复杂无法被回收。它们污染地下水、空气和土壤,对农作物也产生巨大的影响,甚至危害人类的健康和安全。
因此,废旧塑料的回收再利用是一个复杂而急切等待处理的问题。目前存在的一个潜在解决方案就是利用塑料废料作为太阳能转化为氢能的原料。
自从TiO2半导体材料在1972年被发现可用于光催化分解水制氢以来,半导体光催化技术被科研人员看作是一项有前途的技术。

光催化分解水制氢由于具备可以将太阳能转化为清洁能源并且不会造成二次污染的优点,目前已经成为最有潜力解决能源短缺和环境污染问题的方法之一。
H2的制取方法(1)实验室制氢
1、在紫外线灯照射下,利用光催化剂将水分解;
2、将水和陶瓷反应制取氢气;
3、利用生物质裂解油获取氢气;
7、利用厌氧微生物和细菌发酵制备氢气;
8、用二氧化钛做催化剂,在激光的照射下,让水分解成氢气和氧气;9、太阳能光催化水分解制取氢气;
在太阳能照射下,从水中制取氢气是最佳的制取氢气的方法。因为太阳能能量丰富充足,取用方便并且清洁无污染。怎样制取氢气的成本就大大降低。
光催化水分解制氢原理光催化分解水制氢不光可以解决环境污染问题,还可以将太阳能转化为可再生氢能以解决能源短缺问题。
光催化水分解反应利用太阳能分解水,产生的H2和O2分别储存。由于水是一种比较稳定的化合物,需要外界的力量才能使之分解。
如公式所示:水在光的照射下可以分解为H2和O2:
H20→H2↑+1/202↑(1.1)
根据电化学方面的知识可知水分解电压为1.23V,只要施加一个比1.23eV高的能量,就能将水分解为氢气和氧气。
如果要实现光催化水分解,必须满足半导体的能带结构与其电化学原理相匹配。因此半导体的禁带宽度应该大于1.23eV。

并且其价带位置应该比水氧化为氧气的电位更正,导带位置应该比水还原为氢气的电位更负。
半导体的价带和导带位置对其氧化还原能力有着重要的影响,合适的价导带位置才能实现光催化复分解反应。
半导体光催化技术原理及光催化效率影响因素半导体催化剂在半导体光催化技术中起到了主导作用,根据固体能带理论可以知道,半导体能带结构主要包括:导带(CB)、价带(VB)和禁带,禁带大小称为禁带宽度。
(1)第一步是吸收光子形成电子-空穴对,这要求半导体有一个合适的禁带宽度以及价导带位置能够使得一束能量大于1.23eV的光照射激发后,价带电子能够跃迁到导带上;
(2)第二步包括光生载流子的电荷分离和迁移,晶体结构、结晶度和粒度强烈影响该步骤。
缺陷是半导体内电子和空穴复合的中心,其跟随晶体质量升高而减少,从而使得光催化性能变差。

假如半导体尺寸减小,那么光生载流子的迁移距离变短,从而使得复合的概率降低;
(3)第三步与表面化学反应相关,重要的因素有表面活性位点和表面积,即使光生电子-空穴对在热力学上能够分解水,但如果表面上没有具备参与氧化还原反应的活性位点,那么电子-空穴将不得不相互重组。

(1)能带结构
能带结构是影响半导体光催化活性的重要影响因素,带隙决定了吸收光子的能量和产生激发光电子的能量,能带位置决定了催化剂的氧化还原电位。
当受到一个能量大于或等于半导体禁带宽度的光时,促使半导体价带电子跃迁到导带成为激发态电子,将在价带中生成空穴,从而形成光生电子-空穴对,进而在催化剂的表面发生氧化还原反应。

宽度和价带导带位置,可以初步判断哪些半导体材料适合光催化水分解析出H2,哪些半导体材料适合光催化水分解产生O2和氧化降解塑料污染物。
例如,光催化水分解本质上是光生电子与水分子反应生成H2,光生空穴与水分子反应生成O2的过程。光催化水分解在热力学上通常需要满足以下两个条件:
第一,半导体的带隙需大于1.23eV,然而考虑到能量损失的实际问题,一般来说,半导体催化剂的带隙宽度大于1.80eV是最合适的。
第二,对于光催化析氢反应,半导体材料的导带必须比H+还原成H2的电势更负;对于光催化氧析出反应,半导体光催化剂的价带必须比水分子氧化成O2的电位更正。
(2)形貌结构与比表面积
一般而言,催化剂的活性受比表面积影响,材料的比表面积越大,提供的活性位点也就越多,从而更有利于推动光催化活性的挺高。
此外,比表面积、光吸收能力、催化剂粒径尺寸和晶面选择性暴露等与形貌结构都息息相关。

(3)电子空穴对的寿命
半导体催化过程中,价带电子被激发后跃迁到导带而产生空穴,从而获得电子-空穴对,即光生载流子。电子-空穴对迁移到催化剂表面,发生氧化还原反应,产生氢气和氧气。
在迁移过程中,电子-空穴会复合,导致催化活性降低。因此,电子-空穴对存活的时长是影响催化活性的重要因素之一。

研究表明不同晶格的TiO2具有不同的活性,其中锐钛矿型的TiO2表现的活性最高,这是由于锐钛矿型TiO2(3.2eV)比板岩型TiO2(3.4eV)具有更优的带隙结构,更有利于推动光催化反应进行。
在室温条件下,锐钛矿型TiO2比金红石型TiO2具有更高的动力学稳定性,因此TiO2因为其优异的特性成为热门的光催化材料。

但是由于TiO2的禁带宽度只能对紫外光响应,而紫外光只占太阳的一小部分,这非常限制该材料的进一步应用。为了能够拓宽其应用领域,提高其光催化性能。
尤其是在可见光照射下的光催化性能,研究人员对TiO2尝试进行改性,例如非金属离子掺杂,金属离子掺杂和半导体复合等。
ZnxCd1-xS的制备方法
水热法和溶剂热法是催化剂合成中最常见、最简单的方法。将原料加入去离子水或溶剂中,搅拌均匀,装入反应器,在恒温烘箱中加热固定时间,即可完成反应。
用Zn(OAc)2·2H2O和Cd(OAc)2·2H2O和硫代乙酰胺作为原料,在180℃下采用水热法合成了Zn0.33Cd0.67S,展现了较高的光催化产氢活性。
用Cd(CH3COO)2·2H2O和Zn(CH3COO)2·2H2O和硫代乙酰胺加入去离子水中,在180℃下反应24小时,最终获得T-CdxZn1-xS催化剂具有高效的催化性能和优异的表观量子产率。

目前,MnO2的制备方法有水热法、固相法、溶胶-凝胶法、化学共沉淀法和热分解法等,制备方法的不同也会影响MnO2的形貌、晶型和结构发生改变。
(1)水热法
水热法操作简单、便捷并且能够控制样品的形貌、结构和尺寸,用水热法制备的材料具有纯度高、分散性好和粒径小等优点。将MnCl2和NaClO4·H2O混合液加入反应釜。

(2)固相法
固相法是一种传统的制备工艺,普遍应用于纳米材料的制备。将MnC4H6O4•4H2O和KMnO4研磨,将混合物放到烧杯中,在80℃水浴保温10h,然后放入马弗炉中300℃煅烧3h,获得了MnO2颗粒。
(3)溶胶-凝胶法
目前应用制备纳米材料应用最广泛的方法是溶胶-凝胶法,它也是制备纳米金属氧化物催化剂的理想方法。这种方法通常是将溶液中的金属盐或硅氧烷水解缩合形成溶胶溶液。

(4)化学共沉淀法
化学共沉淀法具有操作简便、温度低、成本低等优点,但合成样品易团聚。在室温下将KMnO4和油酸加入去离子水中,持续反应24小时,制成了以MnO2纳米片自组装而成的蜂窝结构的纳米微球。
(5)热分解法
早在1950年,Lamer和Dinegar就研究了热分解法,结论是在合成单分散纳米晶体时,需要片刻的、不连续地成核阶段,然后控制晶核生长。
在此基础上,通过水热处理使用不同浓度的Mn(NO2)2溶液,获得具有不同晶型和形貌的纳米MnO2。所涉及的热分解反应方程式为:
Mn(NO2)2=MnO2+2NO
4NO+O2+2H2O=4HNO2

氢氟酸刻蚀法是合成MXene材料最常见的方法。目前,实验室合成MXene的方法基本是通过控制反应时间和氢氟酸的浓度合成的,如Ti3C2、Ta4C3、V2C等等。
其中,研究最多的MXene材料就是Ti3C2Tx,反应过程如下:
Ti3AlC2+3HF→AlF3+3/2H2+Ti3C2(1.4)Ti3C2+2H2O→Ti3C2(OH)2+H2(1.5)Ti3C2+2HF→Ti3C2F2+H2(1.6)
结语(1)本文探究了ZnxCd1-xS基对光催化水分解产氢耦合塑料降解的影响,除了硫化物基的催化剂,还有更多有着优异光催化活性的催化剂等待开发研究,接下来的工作中,可以考虑其他更新颖、更有潜力的半导体材料。
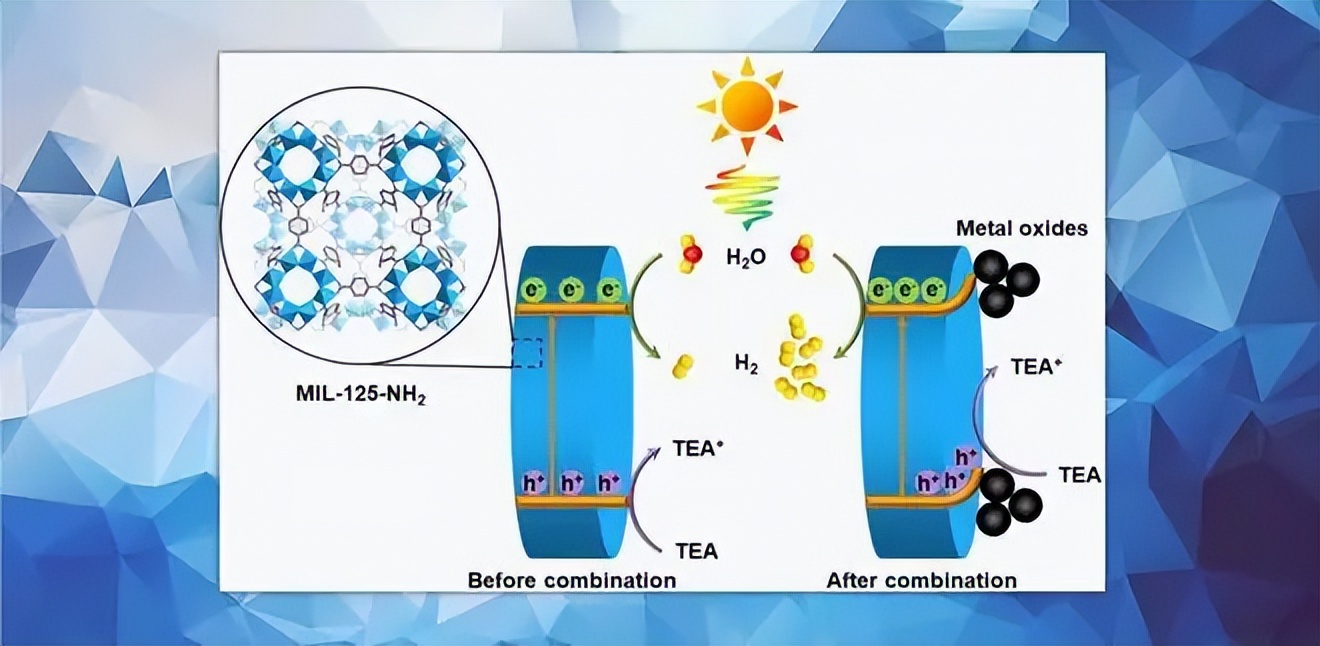
(2)本文主要探究了Z-scheme异质结合引入助催化剂对光催化性能的影响。元素掺杂、离子交换、调控形貌等多种方法可以用以改善光催化性能,在今后的工作中,可以尝试多种方法联合进一步提高光催化水分解产氢性能。
