
文 |史记新说
编辑 | 史记新说
简介可再生原材料的使用和生物质增值的不同策略的开发,以及多相催化,是替代化石燃料资源以获得高附加值的中间体和最终化学产品的有效替代方案。
纤维素是最丰富的碳水化合物,它是不可食用的。因此,它有望成为生物质资源化学的第一个目标。
通过降解纤维素生物质,可以获得单糖,二糖和低聚糖,而这些低聚糖又可以转化为有价值的最终化学产品或中间体。从纤维素生物质衍生的最重要的化学产品是糖醇。

2004年,美国能源部将D-山梨糖醇确定为可以从生物质中获得的12种最重要的增值化学物质之一。
D-山梨醇是液体生物燃料烷烃的潜在来源。D-山梨糖醇的酯和其他衍生物也是化妆品和制药工业中重要的添加剂和中间体,该分子是食品和饮料工业中糖的关键替代品。
山梨糖醇是葡萄糖氢化的主要产物。然而,虽然D-葡萄糖氢化为D-山梨醇似乎是一个简单的反应,但D-葡萄糖不仅选择性地转化为D-山梨糖醇,而且还会产生许多其他副产物(见图1)。
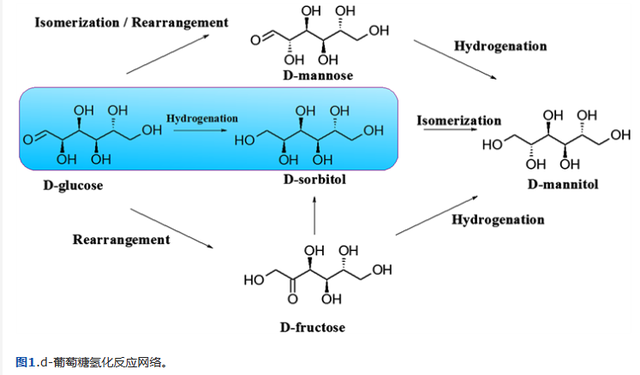
其中一些副产物甚至会导致催化剂失活。山梨糖醇与其他己糖醇一样,也可以在水溶液中容易与镍(或Cu,Fe)形成螯合物。这些络合物在碱性条件下是稳定的,这导致镍留在山梨醇溶液中。
在可能的竞争反应中,D-葡萄糖的Bruyn-Alberda van Ekenstein的Lobry重排导致D-甘露糖和D-果糖的形成。
醛(甘油醛、甲醛)和酮(二羟基丙酮)可能起源于糖分子的碱性介质中的裂解。该反应通过烯二醇中间体通过质子转移机制发生。
D-葡萄糖液相中的氢化通常导致D-山梨醇作为主要产物,但碱性条件可能有利于葡萄糖异构化和山梨醇氢解过程,使甘露醇作为主要副产物和低级醇,如丙二醇和乙二醇。
另一方面,在酸性条件下,5-羟甲基糠醛和乙酰丙酸可以通过葡萄糖脱水形成。调整所需产物选择性的方法是通过正确选择活性金属、催化载体以及温度和氢气压力等反应条件。

从历史上看,葡萄糖已通过Ni催化剂氢化为山梨糖醇。与其他更昂贵的催化系统相比,使用Ni催化剂的优点之一是其相对较低的价格。
然而,Ni存在浸出问题,因此,纯化获得的山梨醇是必要的。已经发现,钌基催化剂的性能优于镍基催化剂,因为它们具有高活性,较低的负载要求和较低的失活率。显然,金属钌作为原材料的价格远高于镍。
但是,在比较每种催化剂的最终成本时,必须考虑其他问题。因此,必须分析催化剂的金属负载及其重复使用的可能性。因此,尽管它比镍贵,但它可能对工业用途感兴趣。

Ahmed和Hameed最近回顾了不同Ru催化剂在不同反应条件下葡萄糖氢化的动力学。
作者描述了已发表的动力学数据结果以及葡萄糖初始浓度,温度和压力对速率常数和山梨糖醇选择性的影响。然而,这些结果中的大多数是在高压力和温度值下获得的。
作为贡献,在这项工作中,研究了葡萄糖在3wt%Ru / C催化剂上的水相加氢(APH),建立了低于通常报道的温度,压力和搅拌的温和条件,并优化了所需产物的获得。
动力学建模是使用基于Langmuir-Hinshelwood-Hougen-Watson(LHHW)动力学的模型开发的。
 催化剂制备和表征
催化剂制备和表征根据参考文献[3],通过在商业活性炭(C)(NORIT,研磨并筛至60 - 100目)上用过量溶液浸渍来制备金属负载量为18重量%的Ru催化剂。
支撑的质地特性,孔体积(VP)和比表面积(S打赌) 由 N 建立2使用Micromeritics ASAP 77设备在2020 K下物理吸附。
金属颗粒的尺寸分布通过透射电子显微镜(TEM)和JEOL 100 CX II显微镜测定。平均粒径(d透射电镜) 使用公式 (1) 计算:

d我是粒子的直径和n我 是具有大小的粒子数d,使用实验室构建的设备通过程序升温还原(TPR)实验研究了催化剂的还原性。
并在配备双Mg/Al X射线源和PHOIBOS 150半球形分析仪的Specs多技术系统(SPECS)上进行X射线光电子能谱(XPS)分析,该系统在固定分析仪透射(FAT)模式下运行。
两种表征均按照先前发表的协议进行。
催化测试测试在高压反应器中进行,使用0.25 g催化剂和50 mL水作为溶剂。反应时间为7小时。搅拌速度、温度、压力和初始葡萄糖浓度分别在250 - 700 rpm、343 - 383 K、0.5 - 2 MPa和0.033 - 0.133 M之间变化。一次修改一个变量,使其他变量在每个测试中保持不变。
在配备RI检测器的UHPLC色谱仪(工作频率为313 K)中通过液相色谱离线分析反应样品。组分的分离是通过Phenomenex Rezex RCM Ca实现的+2单糖(300 × 7.8 mm)色谱柱在353 K下操作,洗脱以0.6 mL/min流动相(毫Q-水)流速进行。
葡萄糖(Glu)的转换使用以下表达式计算:

验证分析标准以确定不存在扩散限制,并使用Langmuir-Hinshelwood-Hougen-Watson(LHHW)的异质模型通过动力学建模来解释实验结果。
催化剂表征用作支撑的活性炭的孔容积为0.53厘米3∙g−1和 S打赌的 1000 m2∙g−1由 N 测量2物理吸附。3 wt% Ru/C 催化剂已被深入表征,如之前发表的。为了更好地解释动力学结果,催化剂的主要特性收集在表1中。
简而言之,可以说TEM分析显示存在小和均匀大小的颗粒广泛分散,Ru是金属形式,正如XPS和TPR分析所证实的那样。

表 1.Ru 3 wt%/C催化剂的制备和表征.
 传质限制
传质限制使用分析标准将初始反应速率与物理阶段的最大传输速率进行比较。在液相反氢反应的情况下,必须评估试剂和/或产物在气-液界面、液-固界面中的扩散以及颗粒中的内部扩散。
用于确定初始反应速率的反应条件为363 K,1.25 MPa的H2压力,搅拌速度为625转/分,使用0.25克3重量%Ru/C催化剂和0.90克葡萄糖作为底物。根据转化率与时间曲线,在10%转化率下计算初始反应速率。
气液传质限制确保对H没有抵抗力2在气液界面处的传递,该准则由观察到的反应速率与基于液体体积的最大传输速率之间的比率确定(α1) 被使用。

该准则指出,如果观察到的反应速率小于最大气液传质速率的10%,则传输过程比观察到的化学反应快得多,因此不会限制整个过程。
对于计算kL- G系数 可以使用由不同作者确定的几种相关性。其中之一是Meille等人提出的。谁研究了确定kL⋅-G
实验室罐式反应器的系数,带磁力搅拌,不使用挡板,体积在 25 到 300 cm 之间3(与本工作中使用的系统具有相似属性的系统)。考虑 150 厘米的反应器3容量,与这项工作中使用的容量最相似,相关性是:

中收集的结果表明,在本工作采用的条件下,H2在气液界面和反应体积内传递。
液固传质限制为了确定液-固界面中试剂是否存在传质限制,所选准则与气-液界面相似。在这种情况下(α2) (H2和葡萄糖),反应速率与质量传递速率之间的比率必须小于10%(公式(5))。

如表2所示,对于所测试的条件,葡萄糖和H2。
内部扩散限制为了验证催化剂颗粒内部是否存在传质阻力,对两种反应物都使用了Weisz-Prater准则(H2和葡萄糖)。根据该标准,如果满足以下条件,则传质限制可以忽略不计:

对于两个 H2和葡萄糖,满足Weisz-Prater准则,因为对于两种反应物,Φ的值远小于1(见表2)。因此,可以说粒子内传质没有限制。
搅拌速度的影响在浆料反应器中搅拌反应混合物不仅对于保持催化剂颗粒均匀悬浮很重要,而且对于促进气态反应物通过气液界面和溶解在液体介质中的试剂向催化剂表面的运输也很重要,存在搅拌速度的提高与传质系数的增加之间的关系。

表 2.用于验证传输限制的参数和相关性。
为了确保气液界面中没有传质限制,进行了在250 K和700.363 MPa的H下在1至25 rpm之间改变搅拌速度的实验2压力,以0.25gRu / C催化剂和0.90g葡萄糖为底物。
图2显示了初始反应速率(r我),对于每个搅拌速度,根据转换与时间曲线的斜率(在10%转换时)计算。当搅拌速度低于约 600 rpm 时,(r我)减小,表明存在气液界面处氢气转移的限制。出于这个原因,后续测试采用了 625 rpm 的速度。
反应参数的影响温度对1.25 MPa H催化活性的影响2并研究0.1 M葡萄糖(图3),其值从343 K变化到383 K。
低于353 K,反应速率显著降低,反应80小时后在343 K处仅达到7%的葡萄糖转化率。在373K以上,观察到实现完全转换所需的时间减少到5小时。
然而在研究的总时间(7小时)中,在363 K下,实现了99%的转换。因此,尽管时间较长,但在较温和的条件下可实现高转化率。
在所有情况下,对山梨醇的选择性均为100%,证明不会发生连续或平行反应,例如异构化(见图1)。


表观活化能(Ea)通过使用阿伦尼乌斯型函数的线性回归确定。获得的值为 30.8 kJ/mol。该值与文献中报道的值相似。
因此,已经报道了使用不同钌催化剂和各种实验条件的动力学数据。从这个意义上说,Mishra等人已经报到了32.9 kJ / mol的活化能和与葡萄糖浓度有关的一级动力学。
在 Ru/HY 沸石上。克雷兹等. 报道在 55 MPa H 下的活化能为 4 kJ/mol2和 0.75 g/L 的 5% Ru/C.在与其他单糖进行的研究中也报告了类似的值。
使用Ru-P催化剂加氢的麦芽糖的表观活化能(Ea)为27 kJ / mol(6.45 kcal / mol),Ru-B为32 kJ / mol(7.65 kcal / mol),使用40% w / v,363 K,2 MPa压力的麦芽糖溶液并以1200 rpm搅拌。
氢分压(在363 K和0.1 M葡萄糖下)的影响如图4所示。
据观察,在每种情况下都获得了几乎完全的转换,增加r我随着压力的增加。压力的变化不会产生选择性的变化,因此获得山梨醇作为唯一的产物。
关于氢的反应顺序是通过考虑以下因素计算的:r我幂律速率方程:

获得的数据的线性回归显示了相对于H2的 0.586。该值与Zhang等人报告的值合理一致。比二氧化硅负载的Pt纳米颗粒高66.6,图卡克告知的0.65。
后一个值是在葡萄糖的催化氢化中获得的,使用40wt%的D-葡萄糖水溶液和硅藻土负载镍催化剂(12%镍锰,2%铬2O3).温度范围为388至433 K,压力范围为0.5 - 10 MPa。

初始葡萄糖浓度(在363K和1.25MPa)的变化结果如图5所示。
尽管反应7小时后达到的最终转化率降低,但催化剂的活性随着葡萄糖浓度的增加而增加。通过公式(8)数据的线性回归确定葡萄糖的反应顺序,得到0.406的值。
在文献中,已经报道葡萄糖浓度对氢化速率具有相对复杂的影响。郭等研究Ru-B无定形催化剂,观察到增加葡萄糖浓度时,初始速率线性增加高达40重量%,然后在较高的葡萄糖浓度下呈现平台。
这种动力学行为可以通过葡萄糖和氢在催化剂上的吸附强度来解释。葡萄糖分子在催化剂上强烈吸附,即使在低浓度下也能达到饱和吸附。只有当液相中的葡萄糖浓度非常低,因此表面吸附不饱和时,加氢速率才随着葡萄糖浓度的增长而增长。
D-葡萄糖的催化氢化通常通过Langmuir-Hinshelwood动力学描述,从低浓度时D-葡萄糖的一阶依赖性转变为高浓度时的零级行为。
动力学建模基于上述结果,考虑了以下LHHW模型的假设:
1)浅表氢化反应是不可逆的(在进行的实验中获得葡萄糖到山梨醇的总转化)。
2)液相中的氢气浓度是恒定的,由于整个测试过程中氢气的压力恒定,溶剂量大且高效混合。

提出了三种通用模型:第一个模型为Eley-Rideal型,仅吸附葡萄糖在固体催化剂上;第二种模型除了葡萄糖吸附外还吸附了分子氢,第三种模型考虑了氢的解离吸附。
两种型号(2 和 3)都考虑了 H 的竞争性吸附2和葡萄糖。通过假设不同的速率限制步骤(r.l.s.),(H2吸附、葡萄糖吸附或表面化学反应)和山梨醇(反应产物)吸附与否的可能性,分析了19种不同的LHHW亚模型。
使用Runge-Kutta-Merson算法对方程进行数值求解,并在363 K处获得数据。模型参数的估计是通过非线性回归执行的,使用最小化目标函数的Levenberg-Marquardt算法:




表 3.使用 LHHW 模型的模型方程和动力学建模结果概述。
表三显示了建议的LHHW模型,以及估计的参数和相关系数 (r)。在丢弃具有无物理意义的参数后,根据最高r值并使用模型选择准则(MSC)确定模型之间的区别,根据以下等式:

最重要的模型是导致最高 MSC 值的模型。
模型2c,2d,2f,3b,3c,3d和3f的一些估计参数具有负值和/或虚值,这使得它们缺乏动力学和平衡常数的物理意义。因此,这些模型被拒绝。
此外,那些认为山梨醇不被吸附,或本品的解吸是限速步骤(1b,1d,1e,2b,2g,3g)的模型拟合度较差。山梨糖醇的吸附不容忽视,但其解吸并不构成反应速率的限制(在最合适的模型中为0<<100)。
这里提出的用3wt%Ru/C催化剂解释葡萄糖水相氢化的最佳模型(模型3a)认为试剂,葡萄糖和H2吸附在催化剂上(竞争性吸附)得到山梨糖醇,然后解吸。
The H2吸附是解离的,限速步骤是表面化学反应。等式(i)-(iv)显示了描述该过程的基本步骤,其中(iii)是r.l.s.:

图6中,葡萄糖在最佳条件下作为时间函数的转换的实验结果以符号表示,而值此模型估计值以实线表示。
可以看出,实验数据和预测数据之间具有良好的一致性,验证了动力学模型的有效性。
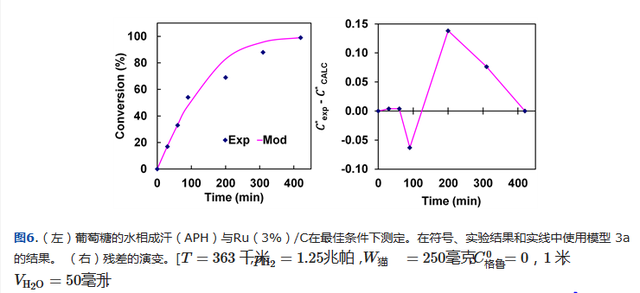
图7显示了所评估的其他条件的模型拟合。除此之外,残差作为时间函数的分布也被显示出来,并遵循可接受的随机趋势,与回归中包含的随机误差假设一致,并为模型的充分性提供了额外的支持。
随后,使用以下表达式建立了动力学和平衡常数与温度的依赖关系:


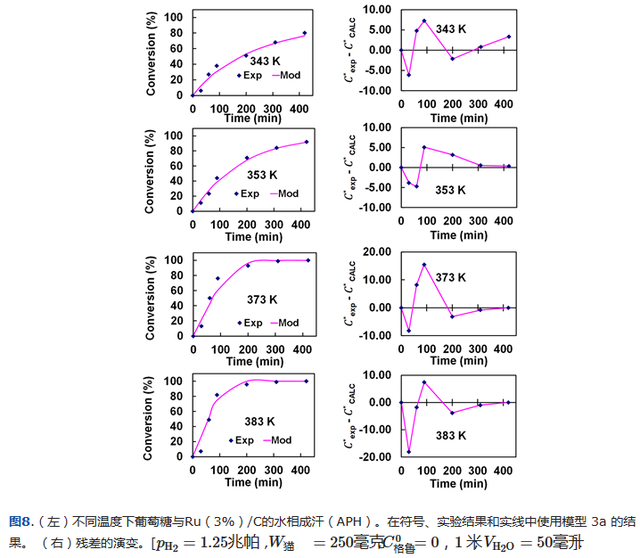
模型 3a 根据获得的 343 - 383 K 数据进行调整。结果如表4所示,而针对评估的不同温度获得的拟合可以在图8中观察到。

表 4.使用所有实验对结果进行建模,包括温度依赖性。
D-葡萄糖吸附焓H一个呈现正值。这表明D-葡萄糖的吸附常数随温度升高而增加。这与吸附现象在热力学上不一致。然而,其他作者已经根据D-葡萄糖吸附的机制描述了这种行为。
根据所进行的动力学研究,并考虑到模型3a提出的反应机理,图9表示负载在碳上的钌原子表面,氢在其上解离吸附,葡萄糖通过其半缩醛基团吸附,导致山梨糖醇的形成,遵循(i)至(iv)描述的基本步骤。
 结论
结论所研究的3 wt% Ru/C催化剂在测试条件下(363 K和1.25 MPa)对山梨醇具有高度选择性。这些实验条件比通常报告的APH反应条件温和。
进行了D-葡萄糖氢化的动力学研究。实验数据可以通过LHHW异构模型进行解释。当考虑葡萄糖和氢的竞争性吸附时,获得了最佳拟合。氢是解离吸附的,限速步骤是表面化学反应。
