Geometric engineering of organoid culture for enhanced organogenesis in a dish是发表于《nature methods》的一篇文章,介绍了一种通过几何工程增强类器官培养的方法,即使用OCTOPUS平台改善营养物质和氧气扩散,促进类器官生长和成熟。该平台可延长肠道类器官寿命,增强其结构和功能成熟度,还可用于构建人类IBD类器官模型和血管化类器官,为类器官技术发展提供了新途径。
*本文只作文献阅读笔记分享*
一、引言
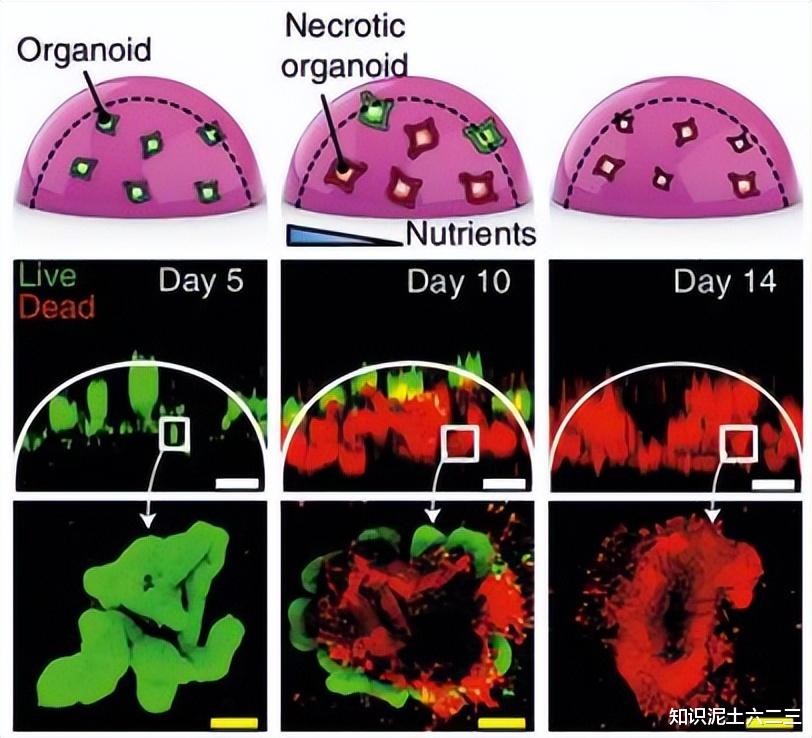
类器官作为研究器官发育、健康和疾病的重要平台,在生物医药应用中具有重要意义。然而,传统类器官培养方法存在营养物质和氧气扩散受限的问题,导致类器官内部形成坏死核心,限制了其生长和成熟。(参考文档中关于传统类器官培养局限性的描述,如在肠道类器官培养中,10天内会出现明显的细胞死亡)
二、OCTOPUS的设计与制造
为解决传统培养方法的问题,我们设计并制造了OCTOPUS(Organoid Culture - based Three - dimensional Organogenesis Platform with Unrestricted Supply of soluble signals)。
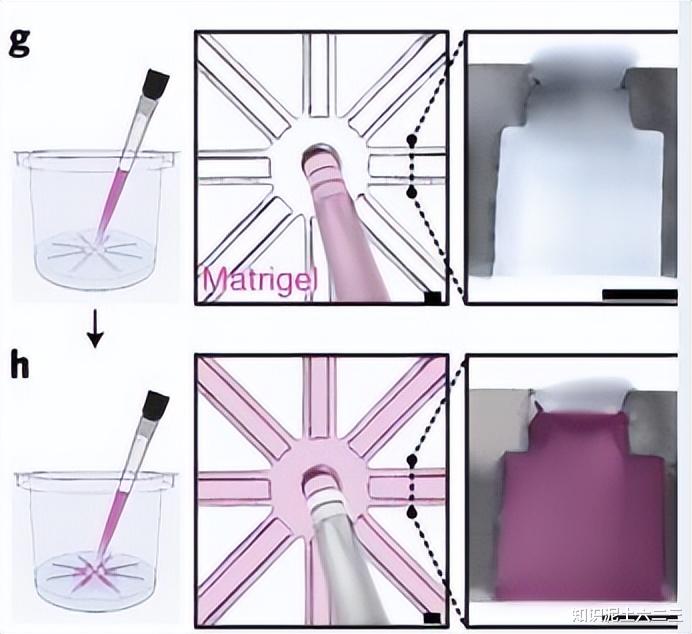
设计原理:将水凝胶滴中的坏死核心去除,同时保留含有活类器官的外层,并将其径向分割并展开,形成平面类器官阵列,以减少培养支架的厚度,促进营养物质、氧气和其他可溶性因子的快速扩散和补充。

装置结构:OCTOPUS由八个相同的培养室组成,从中央加载室辐射出来,培养室与外部环境开放,含有从开口边缘突出的微观台阶。

使用方法:将干细胞悬浮在水凝胶前体中,通过访问端口将其移入中央室,并均匀分布到培养室中,表面张力使液体弯月面固定在台阶上,凝胶化后加入培养基。
三、在OCTOPUS中进行长期肠道类器官培养
我们以小鼠小肠类器官为模型,在OCTOPUS中进行了长期培养实验。
类器官寿命:在培养的前5天,OCTOPUS和Matrigel滴中的细胞都能自我组织成具有活力的肠道类器官,但在5 - 7天后,Matrigel滴中的大部分类器官出现坏死和崩解,而OCTOPUS中的类器官则能继续生长并形成芽,且没有明显的活力损失或不必要的表面粘附。

生长和成熟度:OCTOPUS中的类器官长期存活率更高,生长和成熟度增加,大小变异性降低。例如,OCTOPUS培养的类器官在21天内持续扩大,而Matrigel滴中的类器官在10 - 14天内失去活力和结构完整性。

营养物质和氧气扩散:成像分析显示,OCTOPUS中染料分子和氧气的扩散更快速、均匀,而Matrigel滴中沿支架厚度形成浓度梯度,内部区域分子运输受限。(Extended Data Fig. 2)
四、验证OCTOPUS中类器官的成熟度
为了验证OCTOPUS中类器官的成熟度,我们进行了一系列实验。
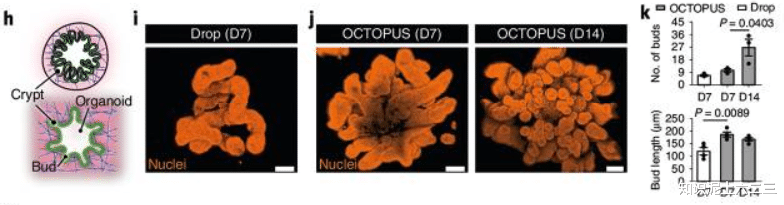
形态和结构发育:OCTOPUS中的小鼠肠道类器官芽形成更多,到第14天,芽数量约为Matrigel滴中的三倍,接近健康小鼠小肠中隐窝的平均数量和深度。
细胞表型:增殖性干细胞/祖细胞(如Lgr5、Ki67和EdU阳性细胞)活性更高,EdU + 细胞在第14天局限于芽的尖端,重现了体内细胞增殖的限制区域;肝细胞核因子4α(Hnf4α)表达更强,表明肠道成熟度更高。
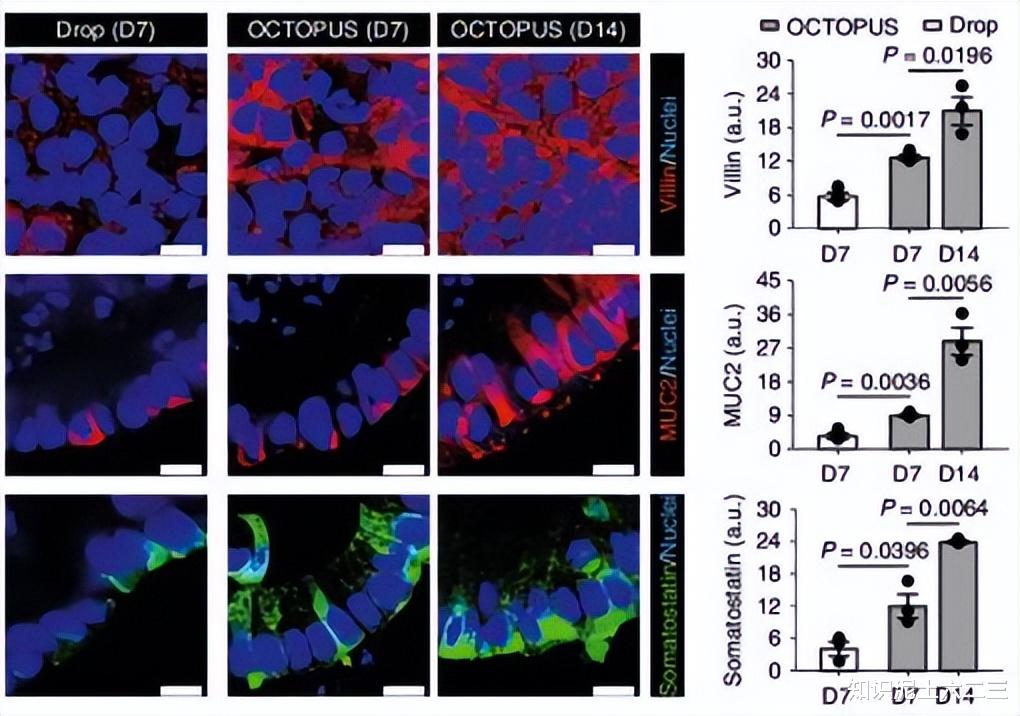
功能成熟度:营养物质转运蛋白(PEPT1和GLUT2)表达更丰富,对葡萄糖刺激的钙信号反应更迅速,响应的类器官比例更高,葡萄糖诱导的GLP - 1和MUC2分泌更高。

五、培养人类肠道类器官
我们使用从健康供体末端回肠分离的干细胞在OCTOPUS中培养人类肠道类器官。
生长和发育情况:在OCTOPUS中,这些细胞在5天内形成球形类器官,随着培养的进行,不断生长的囊性类器官将上皮折叠延伸到周围基质中,而在Matrigel滴中,培养7天后类器官生长停滞且活力降低,没有芽形成的迹象。
细胞特征:OCTOPUS中的类器官具有明显的细胞增殖和分化特征,例如在芽尖端有Ki67 + 增殖细胞,从第7天到第14天,上皮分化增强,KRT20和MUC2等标志物的表达增加,同时生长因子(如IGF - 1和FGF - 2)的产生增加,而这些因子在Matrigel滴培养中浓度较低且随时间减少。
六、对人类类器官进行单细胞测序分析
通过对OCTOPUS中培养的人类类器官进行单细胞RNA测序,我们发现:
细胞异质性和转录谱:OCTOPUS类器官在第7天包含吸收细胞、分泌细胞和干细胞三个细胞群,每个群包含多个由细胞类型特异性基因定义的亚群,与Matrigel滴培养相比,OCTOPUS中吸收细胞谱系在第7天和第14天的丰度更高,还存在一些在Matrigel滴培养中不存在的细胞群体。
干细胞分化轨迹:OCTOPUS中肠道干细胞分化更倾向于成熟肠上皮细胞,增加了肠细胞祖细胞、吸收肠细胞和BEST4 + 肠细胞的丰度,而Matrigel滴中干细胞分化更倾向于分泌细胞谱系。

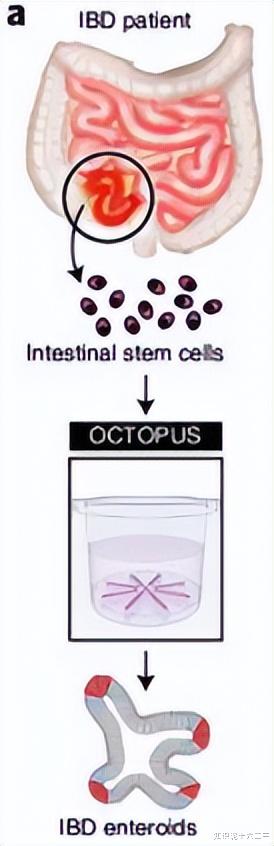
七、构建人类IBD的类器官模型
我们使用来自克罗恩病患者的细胞构建了人类IBD的类器官模型。
形态和生长情况:IBD类器官在OCTOPUS中生长缓慢,芽形成较少,但与健康供体来源的类器官相似。
组织病理学异常:与体内病变肠道上皮的组织病理学异常相匹配,IBD类器官中肠上皮细胞的核增大、核质比升高,增殖能力降低,细胞凋亡增加,上皮屏障完整性受损。
转录组特征:IBD相关基因和MAPK/ERK信号通路调节因子表达增加,还发现了一些在IBD中尚未报道的长链非编码RNA基因上调。
组织纤维化模型:将IBD类器官与原代人类肠道成纤维细胞共培养,与正常类器官相比,IBD构建体中纤维连接蛋白沉积过多,释放的FN水平显著升高,白细胞介素 - 6和肿瘤坏死因子 - α水平也升高,表明出现了自发的纤维化组织重塑。
八、在OCTOPUS中构建血管化、可灌注的类器官
我们设计了OCTOPUS - EVO装置,用于构建血管化、可灌注的类器官。
装置设计:OCTOPUS - EVO由开放的细胞培养室和两个可单独寻址的侧微通道组成,通过注入干细胞、内皮细胞和成纤维细胞的混合液,使干细胞发育成类器官,内皮细胞自组装成血管网络,最终实现血管化类器官的构建和灌注。

血管化类器官的形成和灌注:在OCTOPUS - EVO中成功构建了血管化的类器官,血管化的类器官生长速度更快,IBD类器官中的血管密度和直径降低,表现出促炎表型,在灌注人外周血单核细胞时,能观察到单核细胞的粘附、迁移和浸润等复杂事件。
九、总结
OCTOPUS为类器官技术的发展提供了一个简单而实用的平台,通过重新配置类器官培养的几何结构,改善了营养物质和氧气的扩散,促进了类器官的生长、成熟和功能发展。未来的研究可以进一步探索如何模仿天然器官中特殊组织的集合及其生物相互作用,以开发更成熟和现实的类器官构建体,并将这项技术应用于更多的疾病研究和治疗中。
参考文献
Park SE, et al. Geometric engineering of organoid culture for enhanced organogenesis in a dish. Nat Methods. 2022 Nov;19(11):1449-1460.
