
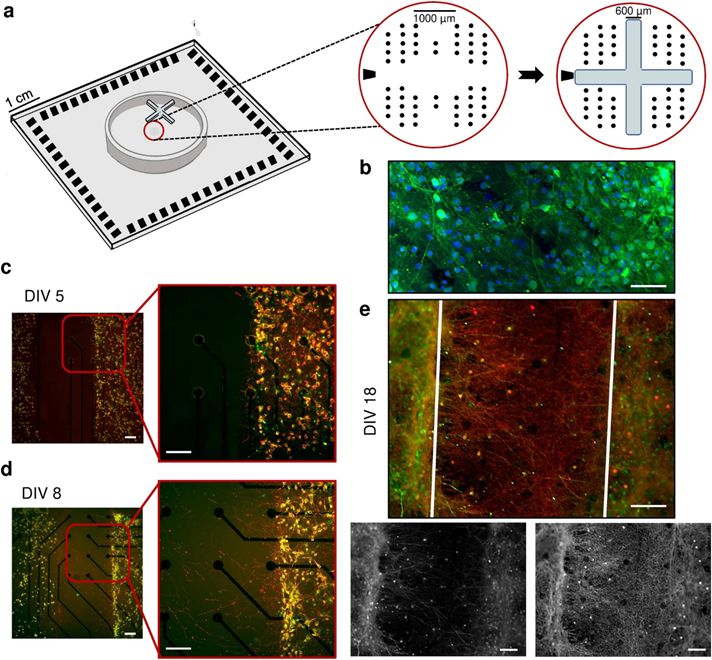
微电极阵列(MEAs)上的聚合物装置:使用聚二甲基硅氧烷(PDMS)约束来塑造网络连通性。本研究实现了两种类型的PDMS约束:十字形和圆形掩模。第一种由等臂十字形掩模(图1a)组成,用于将MEA的有源区域划分为四个部分,实现四个神经网络系统(4N)。第二种采用圆形掩模实现单神经网络系统(1N)。两种类型的掩膜都是通过将PDMS预聚物和固化剂以10:1的比例混合制成,然后对准并可逆地结合到平面微电极阵列(MEAs)上。
实验动物:采用第18-19天的Sprague-Dawley胚胎大鼠(E18-19)作为实验对象。用E18-19胚胎的大脑皮层制备大鼠皮层神经元原代培养物。将神经元原代培养物置于培养基中培育,使神经元组织成形态和功能成熟的神经网络(图1b),再进行免疫荧光染色。
数据集和实验方案:本研究中使用的数据集包括16个四网络系统(4N)和11个单网络系统(1N)作为对照。为了比较4N和1N组件之间时间序列的激活,将控制网络的微电极分组为“虚拟集群”,每个微电极由13个单元组成,以保持与4N组件相同的空间组织。此外,为了研究超极化激活的环核苷酸门控(HCN)通道的作用,记录了3个单网络系统(1N)的活性,通过计算平均放电速率(MFR)抑制的IC50,得出了HCN抑制剂-伊伐布雷定(IVB)合适浓度的剂量-反应曲线。一旦得出这样的值(15µM),在1N上进行5次记录以评估IVB效应。
数据分析:为了检测脉冲的发生,本研究采用了精确时间脉冲检测(PTSD)算法。
结果
本研究首先探索并表征了体外互联亚群(4N)相互作用所产生的自发活动,指出了它们作为起搏器/优势群体的作用。结果与不显示模块化连接的皮质网络(1N)进行了比较。直到神经元亚群由于PDMS十字形掩膜的存在而保持隔离(图1a),它们才在每个隔室内建立了密集的连接(图1b);在去除约束后(DIV 5,体外第5天),种群之间的空间完全没有任何类型的神经性树枝(图1c)。随后,细胞体开始在裂缝中扩展其树突,在PDMS移除3天后(DIV 8),神经突束开始向其他亚群扩展,寻找可能的目标(图1d)。在DIV 18(记录当天),集群之间的远程连接结构良好,足够丰富,可以保证子种群之间的有效连接(图1e),支持物理模块化连接的证据。
由模块化程度调制的峰值和爆发特征
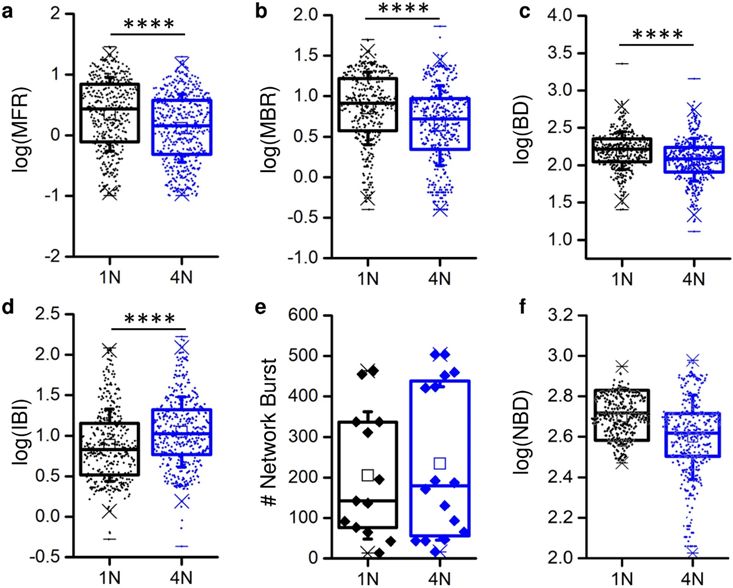
独立于网络拓扑类型(即4N或1N),体外皮层网络表现出自发的电生理活动,其特征是丰富的动态库,从峰值和爆发信号到通过网络爆发的网络全局激活。这种行为与耦合到MEA的同质网络和集群网络是一致的。通过比较1N与4N引起的电生理活动,发现在峰值和破裂活动方面存在显著差异:1N网络的MFR值高于4N(图2a), MBR(图2b)和BD(图2c)也高于1N网络。事实上,IBI值呈现相反的趋势(图2d)。峰值和爆发统计的宏观指标由皮质集合的网络组织调节,而以网络爆发次数(NB,图2e)和网络爆发持续时间(NDB,图2f)为特征的集体活动没有显示出显著差异。
由模块化形成的节律性活动
网络拓扑并没有塑造网络爆发的宏观度量(图2e和2f),相反,它们的传播“模式”受到了影响。为了量化电生理活动的传播,本研究估计了IFR(瞬时发射速率)。图3a显示了1N控制网络的代表性示例。这四条彩色轨迹代表了用于研究网络活动的四个“虚拟集群”。在图3a所示的代表性实验中,种群事件遵循顺时针传播。通过对集群进行颜色编码,网络从紫色集群开始爆发,然后扩散到青色、绿色和红色集群。另一方面,在图3b所示的4N中,可以观察到与在1N中观察到的相比,簇之间的传播模式更多变化,更少定型。本研究还表示了三个网络爆发的IFR曲线:第一个网络爆发显示了逆时针传播,涉及所有四个相互连接的种群(青色-紫红色-绿色),第二个网络爆发只涉及三个亚种群(青色缺失),第三个网络爆发涉及所有随机序列的群集(既不是顺时针也不是逆时针)。

探讨与结论
本研究使用体外实验模型探索了脑神经网络的电生理活动模式,并揭示了起搏神经元活动和神经可塑性在网络行为中的重要性。通过体外实验模型,可以对神经网络进行精细控制和观察,从而深入研究网络活动的基本特征。体外模型的实验设计允许研究人员探索拓扑连接和神经可塑性对网络活动的影响,为脑神经网络行为的底层机制提供了重要线索。然而,这项研究是在体外实验模型中进行的,尽管与体内情况相似,但仍无法完全模拟大脑的复杂性。并且在模拟大脑功能和病理条件时,仍需要更多的研究和实验来验证体外模型的准确性和可重复性。

总的来说,本研究证实了脑起搏神经元活动和神经可塑性在体外神经网络的自发活动中的重要作用。实验结果显示,脑神经网络活动具有起搏神经元依赖的节律性和时空固定的模式,可能与神经可塑性有关。这些发现提供了发展计算模型、理解大脑网络行为和治疗神经系统疾病的重要线索。另外,体外模型的应用还可以拓展到转化医学研究领域,用于研究神经系统疾病的机制和评估药物或刺激方案的效果。
