“永驻青春”是很多人追求的目标,一些人会采取规律运动、健康饮食等措施,甚至还有人尝试过换血疗法。
例如,美国脑机接口与神经科学技术公司Kernel创始人布莱恩·约翰逊(BryanJohnson),曾宣布一项名为“蓝图计划”(Blueprint)的抗衰老干预活动,试图通过置换年轻的血液来降低生理年龄。
需要了解的是,衰老是一个复杂的生物学过程,其涉及多种细胞和分子层面的变化,这些变化的复杂性使得衰老状态的量化评估变得具有挑战。
因此,仅通过血液置换来改变某些生物标志物,并不足以证明器官内部的衰老已得到有效逆转。
那么,能否采用更接近病理学指标的方法,如基于血浆蛋白质水平的“蛋白质年龄”,从而提供更准确和更可靠的衰老评估指标,甚至对与衰老相关的疾病做出预测呢?
此前,英国牛津大学博士生肖思昊脑中闪现的想法,开启了课题组的一项研究。不仅做成了,还实现了超出预期的效果。

近期,牛津大学团队基于机器学习算法开发了一种蛋白质组的衰老时钟模型,称为“蛋白质组衰老时钟”(ProtAge,ProteomicAgeClock)[1]。
该模型在准确量化个体的生理年龄的同时,还可预测与衰老相关的多种慢性疾病的风险。
根据研究结果,ProtAge能够与18种常见慢性疾病的发病率、多病共存和全因死亡风险等建立显著的关联。其中,包括心脏病、肝病、肾病、肺病、糖尿病、神经退行性疾病等14种非癌症疾病,以及4种常见癌症。
研究人员发现,ProtAge同与年龄相关的生物标志物、身体与认知功能指标相关,包括端粒长度、虚弱指数和反应时间等。
尤其值得关注的是,该衰老时钟对阿尔茨海默病的预测显示出强大的潜力。具体来说,生理年龄每增加一岁,患病风险增加约16%。在相同年龄的人群中,生理年龄最大的5%与最年轻的5%相比,患病风险高出约5.8倍。
ProtAge为研究衰老和预测和干预相关疾病提供了一种新工具,并为理解衰老过程提供了全新的视角。

预测衰老:从基于DNA甲基化预测年龄,到用蛋白组数据预测疾病
在预测衰老方面,此前已有广泛使用的模型。
2013年,美国加州大学洛杉矶分校史蒂夫·霍瓦斯(SteveHorvath)教授通过分析DNA甲基化模式,建立了一个能够预测个体的生理学年龄的表观遗传时钟(EpigeneticClock)模型,称为Horvath时钟。
2018年,在此基础上发展的第二代Horvath时钟将甲基化水平与年龄相关的标志物或衰老特征联系起来。这些标志物包括端粒长度、生物标志物或与衰老相关的其他生理变化。
通过这种方式,研究人员试图预测个体的死亡时间或端粒长度,从而建立一个能够反映生物学年龄而非仅是日历年龄的时钟。
值得关注的是,其在预测死亡或衰老相关疾病(如心血管疾病)方面,比实际年龄更准确。然而,这种方法并没有涵盖衰老的所有方面。
牛津大学团队发现,尽管DNA甲基化模型在预测个体年龄方面显示出较高的准确性,但在预测疾病风险和病理分析时,需要考虑更多的生物标志物和分子层面的信息。
2023年,英国生物银行(UKBiobank)发布了大规模包括血浆蛋白质组学特征的蛋白质组数据。在此背景下,他们开始尝试通过蛋白质组数据建立新的衰老时钟模型,旨在能够更准确地预测个体生理年龄,并为疾病预测提供相关信息。
研究人员使用基于梯度提升的机器学习算法和Boruta特征选择算法,来识别和优化与年龄预测相关的蛋白质标志物,不仅能够处理复杂的数据集、识别模式,还增强了蛋白质的准确性和稳定性。
他们从近3000个蛋白质肽段进行筛选,确定了与年龄增长相关的204个关键蛋白质,进而基于这些蛋白质构建了预测模型。
肖思昊表示,与以往预测生理年龄模型最大的不同在于,ProtAge是首次与18种疾病建立强关联的模型,并能够全面地反应生理老化的过程。
他继续说道:“最初我们建模时,并没想到蛋白组数据会对年龄有这么好的预测效果。因此,当我们看到蛋白预测年龄的效果的那一刻,感觉到特别兴奋。”
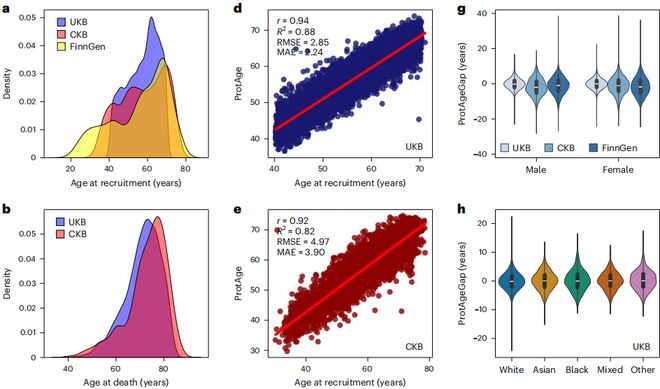
在该研究中,研究人员使用来自英国生物银行(包括45441个样本)、中国和芬兰的总数近5万名参与者的独立验证集,进行多种族和地理区域的验证。
该模型在三个独立人群中的R²值(衡量统计模型预测准确度的指标)分别达到0.88、0.82和0.87,显示出良好的泛化能力,证明了ProtAge在不同种族和地理区域人群中的准确性和普适性。
蛋白质作为生物体内功能性的分子,其稳定性对于维持生物体的正常功能至关重要。与DNA甲基化相比,蛋白质的表达量和功能在不同人群中的变化相对较小,这使得ProtAge成为跨种族和地区人群研究的有力工具。

有望为延缓衰老或改善生活质量提供指导
与传统的DNA甲基化研究相比,ProtAge的研究重点从以往领域关注的DNA层面的早期变化转向了蛋白质层面的晚期变化。
由于后者的变化更接近于导致疾病的生物学过程,使ProtAge能够更直接地关联到疾病的发生和发展,从而揭示出真正代表衰老的生物学特征。
目前,全球多个研究团队已经开始采用ProtAge进行实验验证,例如在研究衰老疾病时,研究人员基于该模型观察蛋白质年龄是否与疾病状态有对应的变化。
此外,在研究高血压、糖尿病等常见疾病的病理特征时,也可通过ProtAge帮助确定吸烟、饮酒等生活方式对生理衰老的具体影响。
另一方面,该模型还可以用于长期监测衰老过程的变化,例如评估睡眠质量和运动对生理衰老的影响,为人们采取措施延缓衰老或改善生活质量提供指导。
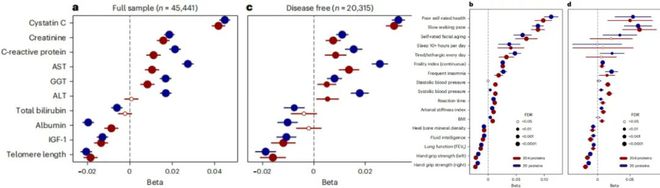
值得关注的是,该课题组通过进一步研究发现,实际上仅使用其中的20个关键蛋白质,就能达到与204个蛋白质相似的预测准确性。
肖思昊表示,该发现在临床应用中具有重要意义,这将使该模型的使用更加易于实施并降低成本。
据悉,目前该团队正在申请相关专利,并计划将这一研究成果转化为实际的临床应用,例如开发基于血液的测试,以帮助医生在早期阶段识别和干预高风险个体。
日前,相关论文以《蛋白质组学衰老时钟可以预测不同人群中常见的与年龄相关的疾病的死亡率和风险》(Proteomicagingclockpredictsmortalityandriskofcommonage-relateddiseasesindiversepopulations)为题发表在NatureMedicine[1]。
牛津大学M·奥斯汀·阿根蒂耶里(M.AustinArgentieri)博士和肖思昊是共同作者,科妮莉亚·M·范·杜伊恩(CorneliaM.vanDujin)教授担任通讯作者。


将推动发展为可广泛应用的商业化产品
肖思昊是一名95后,既有科研训练的经历,也有产业工作的经验。他硕士阶段就读于英国帝国理工学院基因组医学专业,利用全基因组测序数据研究了呼吸系统罕见疾病的新途径。
硕士毕业后,他在基因组研究公司华大基因工作了两年时间,研究的方向涉及泛基因组学、药物基因组学、慢性病和癌症早期诊断等。在此期间,他利用机器学习方法开发了癌症精准诊断和组织来源识别模型。
机器学习相比于传统统计方法所依赖的严格假设,能够捕捉非线性关系、蛋白质间的相互作用关系等生物学特性。其已开始在疾病早期诊断和标志物识别等领域发挥作用,特别是在处理高维度复杂数据时表现出色。
这使机器学习在构建包括癌症、阿尔茨海默病等多种疾病的早期筛查模型中展现出优势,尤其是在面对大量数据(如数千个蛋白或基因)的情况下,得以筛选出相对稳定的关键特征来构建高效、准确的模型。
目前,肖思昊在牛津大学科妮莉亚教授课题组读博,他的主要研究方向是通过机器学习进行衰老相关疾病的研究。
“五十多岁常被视为衰老过程中的重要阶段之一。目前,我投身于该研究方向,旨在通过早期疾病检测和药物靶点的发现来延缓或改善衰老相关的健康问题。能够通过科学研究为更多人提供帮助,是我选择这一研究方向的主要动力。”肖思昊说。
在这项研究基础上,该课题组将进一步探索ProtAge在不同疾病和人群中的关联,并继续探索在临床方面的应用。
下一步,他们计划研究蛋白质年龄与精神相关疾病之间的关系,特别是通过研究分子生物层面的相关机制,建立精神疾病与生理方面的关联。
此外,研究人员也打算继续探索神经退行性疾病等常见衰老疾病与生理年龄相关的研究。
“从更长远的发展来看,希望将ProtAge发展得更智能化,这样人们就可以通过血液标志物检测来了解自己的生理年龄和健康状况。未来,我们计划在国内外推出相关的商业化产品。”肖思昊说。

参考资料:
1.Argentieri,M.A.,Xiao,S.,Bennett,D.etal.Proteomicagingclockpredictsmortalityandriskofcommonage-relateddiseasesindiversepopulations.NatureMedicine(2024).https://doi.org/10.1038/s41591-024-03164-7
运营/排版:刘雅坤、何晨龙
01/
02/
03/
04/
05/

