本硕博先后毕业于浙江大学、美国约翰霍普金斯大学和美国华盛顿大学的黄步威,是2024年新晋诺奖得主、华盛顿大学大卫·贝克课题组的博士毕业生。
博士毕业之后,他加入了由大卫·贝克联合创办的XairaTherapeutics(下称“Xaira”)公司的创始团队。而在入职该公司不久之后,他在博士期间的一作论文也在Nature发表。

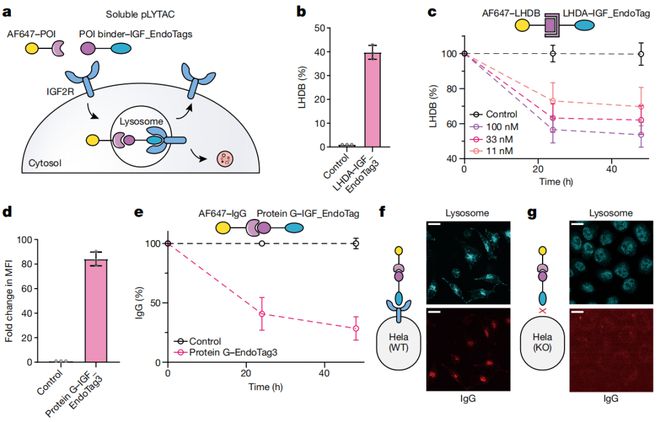
研究中,黄步威和同事研发出一款名为EndoTag的技术。EndoTag是一种完全通过计算设计而来的蛋白质,可以通过结合细胞表面特定受体,来触发细胞的内吞作用,从而将靶向蛋白质送入溶酶体进行降解。
与现有技术相比,EndoTag不仅能够摆脱对于天然配体的依赖,还能通过基因编码的方式直接在体内生成,既简化了制造过程也增强了应用潜力。
详细来说,EndoTag带来了如下几方面新突破。
首先,它能针对多种不同组织实现靶向降解。
例如,EndoTag可以与不同的细胞表面受体进行结合,而这些受体在身体的不同组织中有着特异性的分布,进而可以有针对性地面向不同组织进行蛋白降解。
其次,EndoTag不仅能被用于降解蛋白质,还能促进细胞信号的传递。
例如,在一些依赖内吞的信号通路中,EndoTag能够显著增强信号的强度。
再次,EndoTag系统展示出极强的模块化设计潜力,将能用于癌症和神经退行性疾病的治疗。
在评审专家眼中,本次成果具有五大亮点:
亮点之一,蛋白设计策略比较新颖。审稿人指出,本次研究利用了先进的蛋白质设计策略,让EndoTag技术可以通过结合细胞表面和可溶性靶标,来触发内吞作用并实现靶向降解。
这种方法能在不干扰天然受体信号的情况下靶向多个受体,并表现出极高的降解效率。
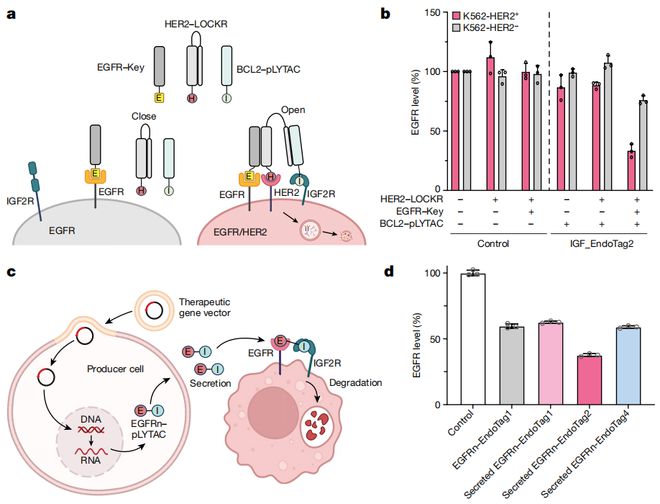
亮点之二,逻辑门控策略增强了特异性。本次研究引入了逻辑门控策略,使得蛋白降解的特异性大大提高。
尤其是在结合合成Notch信号系统时,能够通过目标降解激活细胞信号传递,从而能为精确调控细胞行为提供更高效的方法。
亮点之三,高质量的设计与广泛应用。EndoTag蛋白能够靶向ASGPR、IGF-2R/CI-M6PR、转铁蛋白受体和Sortilin等多种受体,展示了其在降解细胞程序性死亡-配体1(PD-L1,Programmedcelldeath1ligand1)和表皮生长因子受体(EGFR,epidermalgrowthfactorreceptor)等膜蛋白以及可溶性蛋白中的显著效果。
亮点之四,与以往工作有着关键区别。审稿人特别强调,本次工作延续并超越了以往在Nature期刊发表的同类论文。
此前论文主要集中在基于抗体的LYTAC方法,而本次研究结合了Rosetta设计的蛋白质降解技术,提出了新的EndoTag方法,展示了其在靶向蛋白降解领域的巨大潜力。
亮点之五,具有较好的组织特异性和广泛适用性。EndoTag技术被设计为具有组织特异性,不仅可以用于特定的组织靶向降解,还可以通过逻辑门控功能实现更精确的细胞内信号调控。这种广泛的适用性使其在多个生物医学领域具有巨大的应用潜力。
总的来说,审稿人称赞了本次研究的实验质量和广泛的影响力,认为其为靶向蛋白质降解领域提供了一个令人信服的概念验证,展现了计算设计在实际应用中的巨大前景,尤其是在利用内吞作用进行蛋白质降解方面。
黄步威表示,EndoTag技术的应用前景非常广泛,有望在以下几个领域实现应用:
其一,用于癌症治疗。EndoTag可以通过与肿瘤相关的特定受体结合,精准地将抗癌药物递送到癌细胞中,或者直接降解癌细胞表面的特定蛋白质,从而抑制肿瘤的生长。
目前,课题组已经在实验中展示了EndoTag在靶向PD-L1蛋白降解中的有效性,未来有望结合免疫疗法,用于多种癌症的治疗。
其二,用于神经退行性疾病治疗。在诸如阿尔茨海默症或帕金森病等神经退行性疾病中,异常蛋白质的积累是疾病进展的关键原因之一。
而EndoTag技术能被用于这些异常蛋白质的特定降解,从而帮助减缓或阻止疾病的发展。
其三,用于精准药物递送。EndoTag的另一个重要应用是结合抗体或RNA药物,实现更为精准的药物递送。
例如,通过与不同组织中的受体结合,EndoTag可以帮助药物更有效地穿过血脑屏障,靶向大脑中的疾病相关蛋白。
其四,用于免疫疾病治疗。EndoTag还可以用于调节免疫系统,帮助清除自身免疫性疾病中的致病抗体或蛋白质,减轻疾病症状。
其五,用于合成生物学和细胞疗法。EndoTag还具备用于合成生物学领域的潜力。
通过设计特定的EndoTag蛋白质,可以在细胞中控制信号传递,甚至可以通过基因编辑技术将其作为一种“开关”来调控细胞的行为,帮助开发下一代细胞疗法。

“构想大都实现,让我感觉比较自豪”
据黄步威介绍,2021年当他准备博士资格考试时,他构思出了本次课题。构思中,美国斯坦福大学团队此前发表的LYTAC论文给他带来了一定启发。
在斯坦福团队的论文中,研究人员开发了一个使用基于人体自然存在的甘露糖-6-磷酸(M6P,Mannose-6-phosphate)的系统,通过糖化学将多个M6P化学交联在一起,再和结合靶点的单克隆抗体化学交联。
斯坦福团队的这篇论文包含了将近半页的糖化学合成路线,但是黄步威觉得有很大的提升空间,因此他一头扎进M6P对应受体——甘露糖-6-磷酸受体(M6PR,Mannose-6-PhosphateReceptor)的生物机理和结构机理的研究之中。
同时,M6PR是一个自然存在的垃圾处理系统,会结合带有M6P标记的蛋白,也会让胰岛素样生长因子2(IGF-2,insulin-likegrowthfactor2)产生一个巨大的构象变化从而促进细胞吞下,并能带进溶酶体进行降解。
但是,M6PR本身会在进入溶酶体之前逃出来,并回收到细胞表面进行下一个降解过程的循环。
后来,黄步威通过阅读美国德州大学团队解析IGF-2和M6PR构象变化的结构生物学论文,发现这个形变过程非常有意思,于是他便构思使用蛋白设计denovobinder的想法,以便实现更加可控、更加强效的内吞。
在博士资格考试上,当他给自己后来的博士导师大卫·贝克讲完这个思路之后,后者非常喜欢这个idea并给了黄步威很多支持。
第二天,大卫·贝克就给黄步威介绍了一位蛋白降解领域的泰斗,帮助黄步威评估和润色这个课题方向。
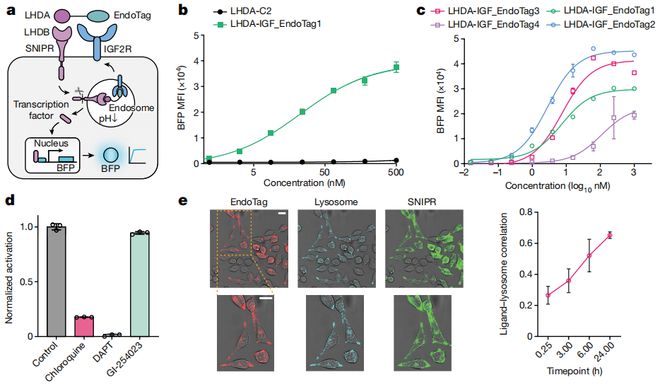
后来通过借助先进的计算工具,以及运用Rosetta等软件,黄步威又针对蛋白质的结构进行设计和优化。
并通过计算机模拟的方法,设计出多个能与细胞表面受体结合、并能引发内吞作用的EndoTag。
完成蛋白质的设计之后,黄步威和同事开始进行实验验证。在酵母展示技术的帮助之下,他们筛选出最具潜力的蛋白质,并在多种细胞模型中进行测试。
实验结果显示:所设计的EndoTag蛋白不仅能够有效触发受体介导的内吞作用,还能将靶向蛋白质成功送入溶酶体进行降解。
同时,在细胞实验上黄步威等人成功降解了EGFR和PD-L1等重要肿瘤靶点。
借此也证实了上述设计思路的可行性,后来黄步威等人和合作者进一步优化和调试系统。
而为了提升EndoTag的效率,课题组又对其结构进行优化,改进了与受体结合的亲和力和特异性。
具体来说,他们针对不同受体进行了多种改进设计,让EndoTag能在不同组织中实现靶向降解。
期间,黄步威等人还尝试将EndoTag与PD-L1抗体药物相结合,测试其在小鼠肿瘤模型中的效果。结果显示,EndoTag能够显著地增强抗体的疗效。
至此,针对本次研究他们实现了“做深”。而为了“做广”,黄步威和同事探索了一些可能的应用。
比如将逻辑门结合到EndoTag,实现双特异性细胞表面的降解;再比如将EndoTag的基因编辑到细胞,让细胞自己产生EndoTag从而降解邻近细胞的靶点,进而以“自产自销”的方式增加效率;再再比如,黄步威的同事通过结合自己的人工设计细胞配体-受体的课题,发现如果把EndoTag连接到人工配体上,可以成百上千倍地提升受体的激活效率,进而能够增加多种细胞疗法的疗效。
最终,相关论文以《设计用于诱导内吞作用的蛋白质降解靶标并放大信号》(Designedendocytosis-inducingproteinsdegradetargetsandamplifysignals)为题发在Nature[1],黄步威是第一作者,大卫·贝克(DavidBaker)担任通讯作者。

黄步威表示:“当初我在开题时曾推演了整条技术路径和可能提升的方向。如今回头来看这些构想大都实现了,所以我还是比较自豪的。”
下一步,大卫·贝克实验室的其他研究人员将在本次成果的基础之上,探讨如何提升EndoTag的回收效率实现和内吞受体实现协同回收,也将进一步扩展当前的EndoTag种类,以便在更多样的组织和细胞中实现特异性的内吞和降解。

加入大卫·贝克最新创业公司
如前所述,不同于课题组的其他研究人员,黄步威在毕业之后走上了“AI+生物”创业这条路,他目前任职于导师大卫·贝克联合创办的Xaira公司。
他表示:“当Xaira启动时,David召集了实验室里有创业想法的博后和博士成立了创始人团队,随后和大家一路开疆拓土到现在。”

该公司由ARCHVenturePartners和ForesiteLabs孵化,拥有10亿美元的风险投资,是生物技术行业历史上最大的投资之一(截至目前,大卫·贝克累计联合创立20多家公司,Xaira只是其中一家)。
而用“豪华”来形容该公司的高管团队或许并不为过,Xaira的创始人兼CEO马克·泰西耶-拉维涅(MarcTessier-Lavigne)博士,是基因泰克(Genentech)公司的前首席科学官以及美国洛克菲勒大学和美国斯坦福大学的前校长。
高管团队中还包括联合创始人赫图·卡米塞蒂(HetuKamisetty)博士,他曾供职于Meta和蛋白质设计研究所。
另一名高管阿文德·拉吉帕尔(ArvindRajpal)博士此前工作于基因泰克公司,还有一名高管是曾在Interline和基因泰克公司工作过的唐·柯克帕特里克(DonKirkpatrick)博士。
Xaira建立在大卫·贝克实验室的RFdiffusion模型的基础之上,该模型可以在短短几周内设计出能与流感分子结合的蛋白质药物。
2024年3月,大卫·贝克团队在预印本平台bioRxiv上发布了关于RFantibody的论文,它能与冠状病毒和流感病毒相结合。开发这些领先模型的核心技术人员大多都已加入Xaira的创始团队,
在Xaira的愿景下,这些科学家们将开发更多更贴近实际药物研发的新模型和新方法,将生物靶点和工程分子的世界与人类疾病联系起来。
参考资料:
1.Huang,B.,Abedi,M.,Ahn,G.etal.Designedendocytosis-inducingproteinsdegradetargetsandamplifysignals.Nature(2024).https://doi.org/10.1038/s41586-024-07948-2
运营/排版:何晨龙
01/
02/
03/
04/
05/

