转自:医药观澜
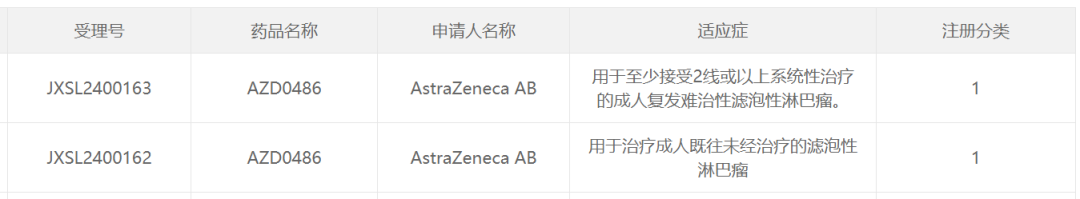
11月15日,中国国家药监局药品审评中心(CDE)官网最新公示,阿斯利康(AstraZeneca)申报的1类新药AZD0486获批两项临床试验默示许可,分别拟用于治疗成人既往未经治疗的滤泡性淋巴瘤;至少接受2线或以上系统性治疗的成人复发难治性滤泡性淋巴瘤。
公开资料显示,AZD0486是阿斯利康在研的一款靶向CD19/CD3的双特异性T细胞衔接蛋白,为下一代T细胞接合器。本次是首次针对滤泡性淋巴瘤(FL)适应症在中国获批临床。在阿斯利康近期公布的临床研究中,该产品用于复发/难治性FL患者(R/RFL)治疗时展现高达96%的总缓解率(ORR),新闻稿表示该产品有望加强现今临床淋巴瘤患者的治疗。
AZD0486的一端可与B细胞表面表达的CD19抗原相结合,另一端与T细胞表面的CD3受体相结合,从而将T细胞重定向到肿瘤细胞,诱导T细胞对肿瘤细胞的杀伤。2022年8月,阿斯利康宣布以总金额超12亿美元完成对TeneoTwo公司的收购,从而获得后者这款在研产品(先前名为TNB-486)。

研究表明,AZD0486含有独特的低亲和力抗CD3片段,旨在减少细胞因子释放,同时保留T细胞介导的对恶性B细胞的有效细胞毒性。沉默的Fc段可防止非特异性结合及抗体依赖性细胞毒性,并具有适合间歇性给药的长半衰期。
在今年的美国血液学会(ASH)年会当中,阿斯利康公布旗下多款血液学管线的临床结果。其中一项临床1期试验结果显示,复发/难治性滤泡性淋巴瘤(R/RFL)患者对2.4毫克及以上剂量的AZD0486高度应答,患者的总缓解率高达96%,完全缓解(CR)率达85%,且患者的最小残留病灶(MRD)阴性比率很高。
根据ClinicalTrials官网,阿斯利康正在开展一项评估AZD0486联合利妥昔单抗治疗此前未经治疗的滤泡性淋巴瘤的3期临床研究,以及一项针对复发或难治性B细胞非霍奇金淋巴瘤(包括滤泡性淋巴瘤)1期临床研究。
在中国,AZD0486治疗复发性或难治性B细胞急性淋巴细胞白血病此前已经获CDE临床试验默示许可。本次在中国获批新的IND,意味着其在中国也迎来新的研发进展。
参考资料:
[1]中国国家药监局药品审评中心官网.RetrievedNov16,2024,fromhttps://www.cde.org.cn/main/xxgk/listpage/da6efd086c099b7fc949121166f0130c
[2]AstraZenecashowcasesstrengthofhaematologyportfolioandpipelineatASH2024.RetrievedNovember7,2024fromhttps://www.astrazeneca.com/media-centre/press-releases/2024/astrazeneca-showcases-strength-of-haematology-portfolio-and-pipeline-at-ash-2024.html
(转自:医药观澜)
