编者按:
2024年12月1日是第37个“世界艾滋病日”,我国今年宣传活动主题为“社会共治,终结艾滋,共享健康”。
终结,是人类对抗疾病的最高理想。自艾滋病被发现以来,全球累计约8300万感染者,治愈案例只有7个。而深入研究这些案例后,会发现治愈之路并非坦途,成功难以复刻。
治愈艾滋病,目前仍是很难实现的终极目标,业界有关治愈的诸多不同方向探索,均未取得预期的成功。但在不断推进的其他研究中,或许提示出新的策略,变相的“治愈”方式。
今年7月,在第25届国际艾滋病大会上,报道了一例可能实现治愈的案例,这位患者被称作第二位“柏林病人”,他也是目前公布的第7例治愈艾滋的案例。从第一位“柏林病人”到最近一位“柏林病人”,7位患者在采用干细胞移植治疗血液肿瘤后,都治愈了艾滋病。
自1981年艾滋病首次被发现,43年间全球累计约8300万感染者,只出现7例治愈案例。因为治疗方法相同,似乎提示疾病走向最终治愈的希望和可能。当我们访谈了业内两位专家,却发现跟想象不同,业界既没有研究清楚治愈的根本原因,也未找到可复制推广的方案,此路其实不通,治愈更像是极低概率的意外。
一个重要的问题,为什么成功治愈的结果并不是有效的治愈路径?
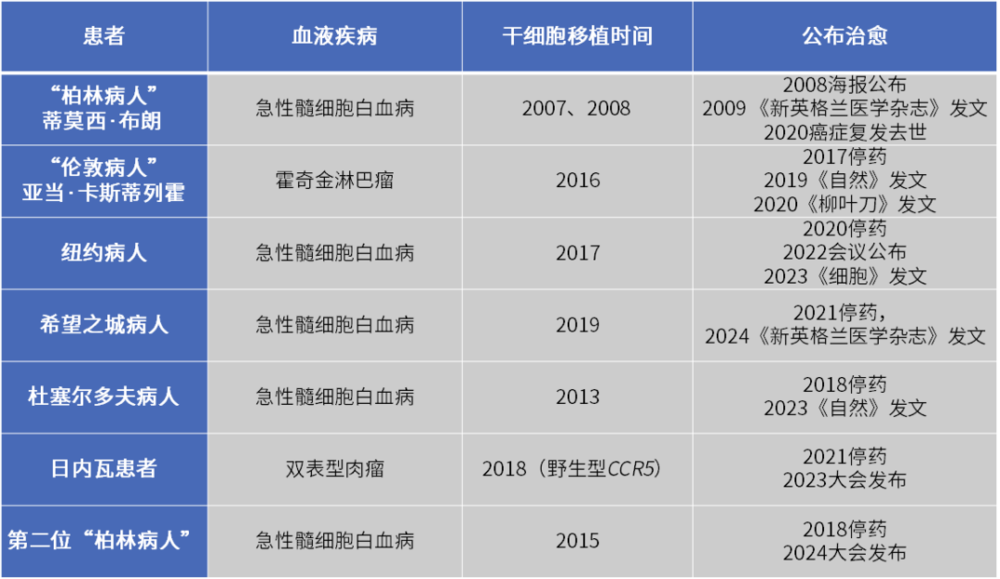
已公布治愈案例丨作者整理
何以治愈?
2006年底,经历四轮化疗后,蒂莫西·布朗(TimothyBrown)的急性髓细胞白血病复发了。第三轮化疗前,他的主治医生曾建议他接受骨髓干细胞移植。
布朗1995年在德国柏林检测出HIV(人类免疫缺陷病毒,也称艾滋病病毒)阳性,主治团队提出的方案,是找到携带抗HIV基因(CCR5Delta32)的捐赠者,在治疗白血病同时让他摆脱艾滋病。
HIV主要感染人体CD4+T细胞。CCR5是人体细胞表达的一类受体蛋白,也是HIV侵入细胞需结合的重要受体之一,而特定突变可以阻碍这条通路,如果感染者移植具有这类突变的捐赠者的干细胞,有可能“免疫”HIV感染。
刚提出干细胞移植方案时,布朗拒绝了,他知道干细胞移植风险高、存活率低。但肿瘤复发让他不得不尝试这种高风险的治疗方案。267场配型后,他们找到一名合适的捐赠者。2007年、2008年,布朗两次接受了同一捐赠者的干细胞移植。
接受第一次移植后,布朗就停用了抗艾滋病药物,3个月后他的体内检测不到HIV病毒,直到2020年因癌症复发去世。13年间,他再未复发。他成为第一例艾滋治愈患者,他的故事出现在学术会议和知名医学期刊上。
“柏林病人”可以说是艾滋治愈研究的开端。业界开始尝试同类别的治疗,或在成功的案例中寻求治愈的原因。布朗后续参与了很多试验,他的血液和活检样本被进一步检测和研究。2015年IciStem联盟成立,专注研究干细胞移植可能带来的治愈HIV感染的潜力。
但现实是,失败远比成功多。很多有着类似情况、也同样采用干细胞移植的患者并没有复刻布朗的成功。2012年,两例患者在干细胞移植8个月后,体内检测不到HIV病毒,但这两位“波士顿病人”,1例在停药12周后复发,1例在停药32周后复发,最终宣告治疗失败。根据2019年的数据,在IciStem联盟注册、已接受干细胞移植的患者达39例,报道出治愈的案例只有“伦敦病人”、“杜塞尔多夫病人”以及“日内瓦病人”。
如果看这些成功治愈的案例,科学家目前发现的更多是他们具有的共同点:应用造血干细胞移植来治疗白血病等血液肿瘤;6例供体为特定CCR5突变的基因型。除此以外,并不能明确带来治愈的关键因素是什么。
病毒感染疾病科学家王宇歌研究艾滋治愈8年,他告诉果壳,业界在这些治愈案例中主要获取三点启示:第一,用治疗血液病而不是普通传染病的方法治疗HIV感染;第二,造血干细胞移植前清除了HIV患者自身全部淋巴造血系统,接受没有HIV感染的淋巴造血系统,且CCR5突变可能让患者体内残存的HIV不再感染细胞;第三,接受CCR5突变移植的患者都发生了强烈的移植物抗宿主反应(GVHR)。
GVHR指移植物中的免疫细胞识别宿主抗原,从而攻击受者器官,可能导致移植失败,甚至威胁受者生命。但GVHR针对宿主全身各个器官产生强烈的免疫应答,可能是治愈艾滋非常关键的一环。总结下来,治愈的发生可能建立在彻底清除患者本身的淋巴造血系统,同时移植后产生强烈免疫反应的情况下。
谈到治愈案例的具体启示,艾迪药业临床开发部总监郓新明也表示:“目前业界总结出的因素是治愈的必要条件还是充分条件并不确定。同样条件的复刻仍难以得到治愈的结果。7例治愈患者是否有其他关键因素影响,或更复杂的因素共同作用,目前也不得而知。且因为成功治愈案例有限,可总结的经验数据尚且不足。现在只能说现有治愈案例能带来一些思考方向,用于进一步研究探索,尚不能作为明确、可推广的治疗路径。”
治疗的副产物,难以复刻的“惨胜”
第二次骨髓干细胞移植后,布朗几乎失明、神志不清,无法走路,因为脑部撕裂伤,他接受了三次脑部手术,在一家为重度脑损伤患者开设的中心重新学习走路。第二例治愈病例,2019年公开信息的“伦敦病人”亚当·卡斯蒂列霍(AdamCastillejo)在移植后一年内并发多种感染,接受了多次手术,面临听力损失的后遗症。
在治愈的所有案例中,干细胞移植主要用于治疗血液肿瘤,治愈HIV是附带过程,而这个过程是一场艰辛的“惨胜”。当我们说这类治愈方法很难推广时,很重要的原因是,干细胞移植并不能应用于普通艾滋病病毒感染者的治疗。
多种抗病毒药物联合使用,即我们熟知的“鸡尾酒疗法”,是目前艾滋病病毒感染常规药物治疗方式,已经可以实现较好的长期控制,如同慢病的管理。只有合并血液肿瘤且其他治疗方法无法控制的艾滋感染者才可能考虑干细胞移植。
据王宇歌介绍,骨髓干细胞移植首先要配型,配型成功的概率约为百万分之一,如果要找到CCR5突变的供体,白人中约0.3%有这类基因突变,配型成功的概率可能降至上亿分之一。而且移植过程操作复杂,有可能产生很严重的排斥反应,目前大概有10%~20%患者因出现排斥反应死亡。实现困难、风险高,在血液肿瘤治疗中,干细胞移植也是化疗、放疗或靶向药均无效后最后的选择。
适用干细胞移植的感染者同样面对极高风险。布朗的主治医生一共给7名患者开展过类似的干细胞移植治疗,除了布朗,其他6位患者没有一位存活超过1年。在能够评估是否战胜HIV之前,4例患者因为干细胞移植后的不良反应、2例因为肿瘤复发而去世。
风险高、结果不明确,造血干细胞移植显然不是治愈路径可以参考的方向。
“过时”靶点,CCR5药物的败局
作为案例中另一个共同点,CCR5也是治愈研究的一大关注方向。它是HIV侵入细胞的重要“通道”,理论上阻断这条“通道”可能阻止HIV感染细胞。
自1995年被发现,CCR5就被认为是一类很有希望的药物开发靶点,在“柏林病人”故事之前,它已经成为研究的热门。针对CCR5的药物开发,投入不少、方向多样,包括CCR5受体抑制剂以及基因编辑产品。
但是当研究不断推进时,业界却发现CCR5可能并不是一个理想的药物开发靶点。
据郓新明介绍,CCR5并不是HIV进入T细胞的唯一途径,研究发现还存在CXCR4路径。也就是说,病毒进入T细胞,可以通过CCR5受体、CXCR4受体,或同时通过两条途径。仅针对CCR5受体开发药物,可能并不会完全阻断HIV进入T细胞,带来预想的作用。
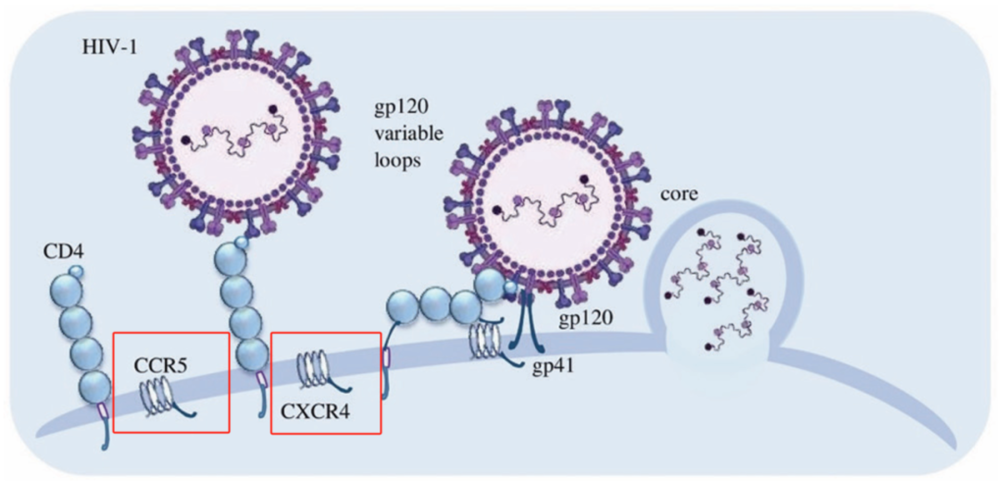
HIV进入T细胞还存在CXCR4路径丨原图:DOI:10.4274/tji.galenos.2022.47965
他表示,更重要的是,CCR5在巨噬细胞、树突状细胞、神经胶质细胞等都有表达,参与多种人体细胞的功能。不像很多抗HIV药物作用于病毒,以CCR5为靶点开发的药物将宿主细胞作为目标,可能会干预宿主细胞正常的活动和功能,产生非预期风险的可能性更高。
实际上,CCR5抑制剂开发大多折戟于安全性问题。最早进入临床试验的产品因为严重的心脏不良反应终止开发,另一款产品因为肝毒性被叫停临床试验。目前,全球只有一款CCR5受体抑制剂获批上市,上市后也因为效果不理想,现实治疗中应用很少。世界卫生组织、各国的治疗指南中,CCR5抑制剂都不在推荐之列。而一些基因编辑的尝试也在进入临床人体试验后因效果不佳销声匿迹,再无进展。
受制于靶点本身的局限性,CCR5方向的药物开发本身就不成功,也没有给治愈带来什么推动。
当此路不通,“治愈”理念也在变化
2020年,国际艾滋病大会上报道了一个案例,一名患者采用5种抗逆转录病毒药物+烟酰胺的口服药方案,在停药15个月后体内未检测到HIV病毒。当时,这位“圣保罗病人”被业界视作直接到达艾滋治疗的终点——低成本治愈。然而,没等到业界验证这种方案的可行性,几个月后“圣保罗病人”又检测到病毒反弹。治愈研究有很多不同尝试方向,“圣保罗病人”正是其中之一,但这些尝试均以失败告终。
治愈艾滋为什么这么难?
受访的两位专家对此做出解释,HIV是一类逆转录病毒,进入人体后可将遗传物质RNA逆转录为DNA片段,这段DNA片段可以整合到宿主细胞的基因中,整合病毒基因组的细胞可能会进入静息状态,成为病毒储藏库。病毒储藏库在人体分布非常广泛,可能存在于外周血、淋巴结、肠道、脾脏甚至大脑和男性生殖器官中。这意味着,一旦感染HIV,即使杀死体内全部病毒,随着病毒储藏库被激活释放,人体也可能变成HIV的生产者,源源不断产生新的病毒。这是目前无法治愈艾滋病最根本的原因。
王宇歌告诉果壳,目前业界“治愈”研究的主流思路是,找到病毒储藏库的激活剂,“震荡”储藏库细胞,同时激活储藏库细胞的复制和HIV的转录,将病毒蛋白质表达在细胞表面,再用能够识别出病毒蛋白的免疫效应细胞杀灭表达HIV蛋白的CD4+T细胞,以此消灭病毒储藏库。这个理论模型诞生12年,但这个方向所有临床研究基本都是失败的。后续业界提出深度沉默病毒储藏库的新思路,让储藏库永远不激活,那么患者停药后可以保证HIV长期不复制。但这一方向目前也并不成功。
业界也尝试过从基因治疗的方向切入。常规基因治疗包括用载体将人体缺失的基因递送到特定位置,产出人体所需的功能物质;或利用载体递送基因编辑器,直接在体内修正错误的基因。这种方案针对的是更根源的、HIV向宿主基因组整合的问题。除了上文提到的针对CCR5的基因编辑产品,已有直接针对HIV病毒的编辑产品EBT-101进入临床试验。
在郓新明看来,理论上,采用病毒载体递送的基因治疗或者体内编辑,对HIV病毒插入位置进行修饰和干扰,使病毒基因沉默,可能是可行的研究方向。但这需要只针对感染细胞进行定向编辑,编辑的基因位点选择也很复杂,沉默病毒基因同时需要考虑是否会影响宿主基因的表达。因此,这一开发方向目前难度较高、风险较大。
EBT-101最近公布了临床结果,3例受试者停药后,2例失败,1例延迟了病毒的反弹,整体结果并不理想。王宇歌表示,由于HIV病毒储藏库分布弥散,基因治疗很难准确投递到每处病毒储藏库,EBT-101使用腺相关病毒载体,这类载体大量富集到肝脏,很难到达其他器官,且要留意基因编辑对非目标基因的影响。这个方向需要验证的问题很多,谈治愈为时尚早。
无论从根源出发,还是从治愈案例入手,目前业界都没有找到通向“治愈”的方法。达成彻底清除体内HIV的治愈可能依然是漫长的,但在现有疗法实现很好控制的基础上,“治愈”的目标似乎在以另一种方式实现。
治疗和预防这两个方向的最新进展中,长效是最重要的趋势。近日美国感染性疾病周(IDWeek)大会上公布一款长效HIV口服组合疗法的临床数据,组合方案(一周一次)抗病毒率达94.2%,不逊色于一日一次的方案;每两个月注射一次的药物已上市两年。预防方面,暴露前预防(PrEP)理念——高暴露风险人群服用推荐药物来降低HIV感染风险——已经达成非常高效的预防,上百万人的荟萃分析显示,只有20人服药后发生了感染;今年7月,长效预防方案lenacapavir(每半年注射一次)发表了最新的研究结果,2000多名受试者中达到了百分百保护。
“其实现在治愈和治疗已经逐渐融合,治愈的核心是让患者不用服药就可以控制疾病,病毒不复制,不传染。如果长效治疗也可以实现长期控制,病毒不复制、不传染,未来或许也可视作一种变相的治愈方式。”王宇歌说。
参考文献
[1]TimothyRayBrown.IamtheBerlinpatient:apersonalreflection.AIDSResearchandHumanRetroviruses.2015Jan;31(1):2-3.
[2]The'LondonPatient,'CuredofH.I.V.,RevealsHisIdentity.Yaleschoolofmedicine.March09,2020.
[3]G.Hütter.MoreonshiftofHIVtropisminstem-celltransplantationwithCCR5delta32/delta32mutation.NEnglJMed.2014;371:2437–2438.
[4]Henrich,T.J.etal.Antiretroviral-freeHIV-1remissionandviralreboundafterallogeneicstemcelltransplantation:reportof2cases.Ann.Intern.Med161,319–327(2014).



让大家慢慢吃药才能躲赚钱