转自:生物谷
日前,从复旦大学附属肿瘤医院传来消息,约占所有乳腺癌近七成的“腔面型”乳腺癌免疫治疗研究获得新突破。该院乳腺外科余科达教授团队发布的一项研究首次证实,酪胺饮食或可增敏“腔面型”乳腺癌对免疫治疗的响应。这一成果有望改变免疫调节治疗对该类乳腺癌疗效不佳的困境,为“腔面型”乳腺癌免疫治疗带来全新认知和治疗路径。《临床研究杂志》(JClinInvest)于11月14日在线发表了这项最新研究。
这种类型乳腺腺癌免疫治疗有点“冷”
作为威胁女性健康的主要“杀手”,乳腺癌其实是一个“大家族”,有着多种分型。其中“激素受体阳性/人表皮生长因子受体2阴性”(即“腔面型”)乳腺癌大约占所有乳腺癌的65-70%。这类乳腺癌治疗主要以手术治疗和内分泌治疗为主,通常情况下预后较好。然而,在临床上,仍然有30-40%的“腔面型”乳腺癌患者面临着内分泌治疗耐药、长期高复发转移风险的挑战,因此亟需开发新的治疗方法提升这部分患者的疗效。
“一旦发生内分泌治疗耐药或复发转移,腔面型乳腺癌患者的生存情况将受到严重影响,5年生存率不足50%,远低于通常情况下腔面型乳腺癌85-90%的5年生存率”,肿瘤医院乳腺外科副主任、主任医师余科达教授表示,“免疫治疗是当前肿瘤学界关注的热点,此前,免疫治疗已经在三阴性乳腺癌中开展研究且证实了临床价值,但在腔面型乳腺癌研究中很少有免疫治疗相关成果。”
据介绍,传统观点认为,“腔面型”乳腺癌是免疫状态相对较“冷”的肿瘤,对免疫治疗疗法不敏感,因此很少有针对“腔面型”乳腺癌的免疫治疗研究。但是,越来越多的证据显示,腔面型乳腺癌具有不同的免疫状态异质性;不仅如此,已经有两项重要临床研究证实免疫治疗对具有一定免疫原性的“腔面型”乳腺癌的有效性。因此,深入挖掘驱动“腔面型”乳腺癌免疫异质性的关键分子事件,并探索相应的干预策略,将帮助更多乳腺癌患者从免疫治疗中获益。

发现“腔面型”乳腺癌免疫疗效“遇冷”关键分子
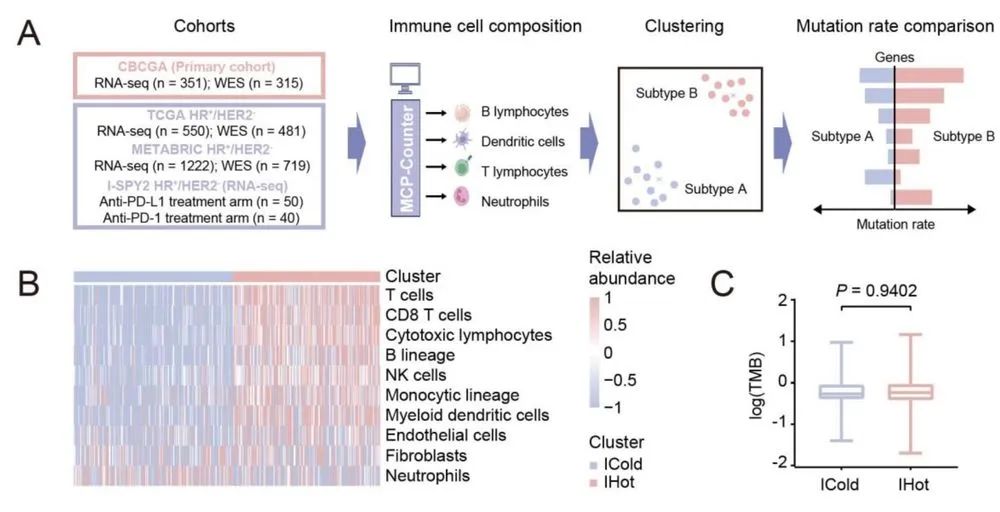
根据既往研究成果,余科达教授研究团队基于中国乳腺癌基因组图谱(CBCGA,351例)队列,并以既往多个大型肿瘤学研究项目作为验证队列开展研究。
项目深入剖析“腔面型”乳腺癌的免疫微环境特征。基于肿瘤的恶性程度和肿瘤细胞生长的活跃度,对其中恶性程度高、肿瘤细胞成长活跃度高的具有潜在“免疫原性”的乳腺癌,开展免疫亚型研究。结果发现,这类“腔面型”乳腺癌主要包含两个免疫亚组:免疫“热”型和免疫“冷”型。其中,免疫“热”型的“腔面型”乳腺癌可以直接尝试抗PD-1等免疫调节治疗疗法;但其中免疫“冷”型因为免疫细胞浸润低、基质细胞浸润高,目前无法对其进行有效的免疫治疗。
值得注意的是,研究团队发现基因MAP3K1体系突变在“腔面型”乳腺癌的免疫“冷”亚群中富集。该基因突变,是否与“腔面型”乳腺癌免疫治疗效果“遇冷”有关?对此,余科达教授团队又开展了进一步研究。
酪胺有望让“腔面型”乳腺癌免疫治疗“由冷转热”
在随后的体外模型研究中,余科达教授团队证实了基因MAP3K1突变可降低“腔面型”乳腺癌的“CD8阳性T淋巴细胞”浸润和激活。就具体机制而言,基因MAP3K1突变导致其编码蛋白丧失了与TAP1/2mRNAs竞争性结合DDX17(一种RNA结合蛋白)的能力,从而促进了TAP1/2mRNAs的不稳定性并加速其降解,进而导致肿瘤细胞表面的MHC-I分子表达下调,造成抗原呈递不足而免疫逃逸。
余科达教授解释说,通俗来讲,肿瘤免疫治疗通过激活人体自身免疫力来杀灭肿瘤细胞。正常细胞和肿瘤细胞表面有不同的“信号”,就是通常所说的“分子表达”。人体自身的免疫细胞会根据不同细胞表面的“信号”差异,识别出肿瘤细胞,进而实施精准杀灭。MHC-I分子就是其中辅助发出“信号”的重要媒介。但是,基因MAP3K1突变导致了一系列连锁反应,让MHC-I分子“信号”减弱,人体免疫细胞无法通过该“信号”识别出肿瘤细胞,让“危险分子”逃过了免疫细胞的攻击,导致免疫治疗失,即“免疫逃逸”。
能否找到方法,再度增强这个减弱的“信号”,以便让免疫细胞更好锁定肿瘤细胞?针对此,余科达教授团队寻找到了可有效逆转MHC-I分子表达下调的微生物代谢物酪胺,并通过体内外实验证实了酪胺可以显著提高MAP3K1突变肿瘤的免疫治疗疗效。临床前数据显示,酪胺可让免疫“冷”型的“腔面型”乳腺癌对传统免疫治疗的有效率提升1倍左右。
余科达教授表示,其实在生活中有很多富含酪胺的食物,如豆腐、奶酪等,通过补给这些食物可以有效补充人体内的酪氨酸。可能有助于重塑“腔面型”乳腺癌的免疫微环境状态,并增加现有抗PD-1等免疫调节治疗的敏感性。当然,其具体效果还有赖于后续更广泛的临床研究来证实。这项研究为“药食同源”也提供了很好的佐证。
复旦大学附属肿瘤医院蔡毓文博士、刘翠翠博士、刘燚铭博士,郑州大学附属第三医院张彦武教授为该论文的第一作者,复旦大学附属肿瘤医院余科达教授为通讯作者。
