转自:医药观澜
今日(12月6日),中国国家药监局药品审评中心(CDE)官网最新公示显示,诺和诺德申报的依柯胰岛素司美格鲁肽注射液上市申请获得受理。公开资料显示,这是诺和诺德研发的复方制品IcoSema。诺和诺德在今年上半年投资者会议上公布了IcoSema在关键3期试验COMBINE1当中取得积极结果,并表示预定在今年下半年向中国、美国、欧盟的监管单位递交该疗法用于治疗2型糖尿病(T2D)患者的上市申请。由此推测,IcoSema本次在中国申报上市的适应症为治疗2型糖尿病。
IcoSema是每周一次依柯胰岛素和每周一次司美格鲁肽(semaglutide)的固定比例组合。依柯胰岛素是人胰岛素类似物,其氨基酸结构有三处进行了替换,并附加了C20二十烷脂肪二酸链,使该分子能够可逆地与白蛋白结合,从而将半衰期延长至196小时(约7天),并在经过3-4次每周一次注射后达到稳定状态。该疗法被设计为一周一次皮下注射使用。依柯胰岛素已在欧盟、加拿大、澳大利亚和日本获得批准,在中国也于今年6月获批上市。司美格鲁肽则是一种胰高糖素样肽-1(GLP-1)类似物,它通过突破性的肽链结构优化,使得分子半衰期延长至7天,实现了一周一次给药且血药浓度非常平稳。

今年6月,诺和诺德公布了IcoSema在关键3期试验COMBINE1当中取得积极结果。COMBINE1试验是一项国际性的3期试验,旨在比较每周一次的IcoSema与每周一次的依柯胰岛素(Icodec)在2型糖尿病患者中的血糖控制效果。该试验共招募1291位患者,随机分配接受IcoSema或依柯胰岛素治疗共52周,并接续为期5周的随访。
分析显示,该试验达成主要终点,与基线相较,IcoSema组患者的糖化血红蛋白(HbA1c)水平在第52周时下降了1.6个百分点,依柯胰岛素组则下降了0.9个百分点,差异具统计学意义。而在次要终点上,IcoSema组患者的体重在52周时下降了3.7公斤,依柯胰岛素组患者则增加了1.9公斤,两组差异具统计学显著性。
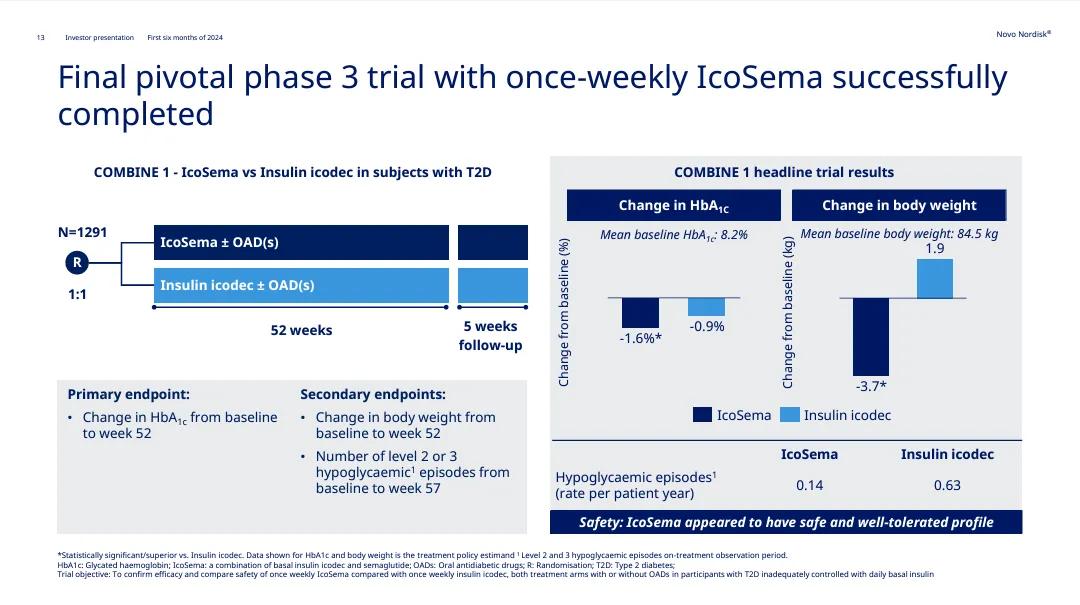
此外,IcoSema组患者发生严重低血糖事件的概率(每患者每年发生0.14次)亦明显低于使用依柯胰岛素治疗的患者(每患者每年发生0.63次)。IcoSema在试验中展现良好的安全性与耐受性。
IcoSema针对2型糖尿病的开发共有三项后期研究。除了COMBINE1,诺和诺德在今年初公布了积极的COMBINE3临床3a期试验数据,结果显示,在679名使用每日一次基础胰岛素控制不佳的2型糖尿病患者中,每周一次的IcoSema与每日注射一次的胰岛素疗法相比,在降低HbA1c上显示具非劣效性。

根据中国药物临床试验与信息公示平台官网显示,诺和诺德已经在中国完成一项IcoSema注射液针对2型糖尿病患者的1期临床研究,即在中国2型糖尿病受试者中比较icodec胰岛素和司美格鲁肽单独或同时给药时作用特点。
参考资料:
[1]中国国家药监局药品审评中心(CDE)官网.RetrievedDec7,2024,fromhttps://www.cde.org.cn/main/xxgk/listpage/4b5255eb0a84820cef4ca3e8b6bbe20c
