
一、行业定义
细胞与基因治疗(CellandGeneTherapy,CGT)是一种是一种通过基因表达、沉默或体外改造手段,在蛋白质水平进行调控的疗法,为癌症、遗传病等疑难杂症提供突破性治疗方案。传统疗法多针对疾病症状,CGT则尝试从根本上修复致病机制。近年来,尽管面临技术、伦理与成本等限制,细胞与基因治疗仍凭借其精准医学的特点,引领医学领域变革。
目前CGT主要递送手段是CGT,包括多用于基因治疗的AVV和多用于细胞疗法的LV。使用最广泛的病毒递送载体是AVV,具有免疫原性极低、安全性高、宿主细胞范围广、扩散能力强、表达稳定以及特异性强等优势。
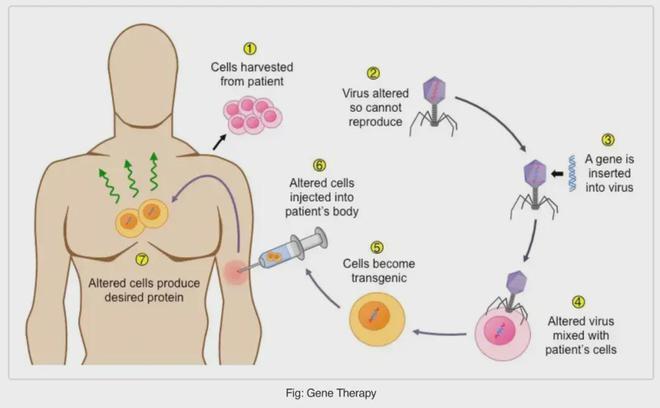
CGT主要分为细胞治疗、基因治疗。细胞与基因治疗主要分为两种,一种是细胞治疗,主要涉及体外治疗,将病患的细胞在体外进行一定修饰后再回输回患者体内,从而达到治疗的效果;另一种是基因治疗,主要涉及体内治疗,将外源的基因导入到患者体内的靶细胞内,然后在基因层面治疗调控蛋白的表达,从而达到治疗疾病的目的。
细胞治疗强调利用活细胞本身或改造细胞实现治疗功能,更适合慢性疾病或再生医学。基因治疗以基因为核心,通过修复、替代或敲除致病基因治疗遗传性疾病。
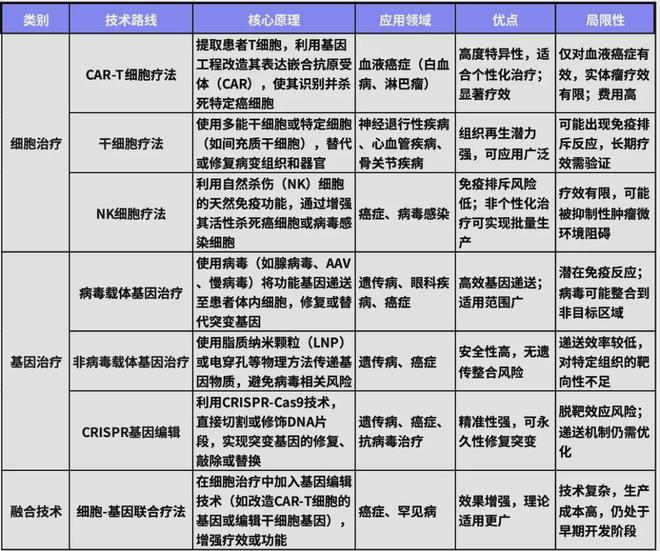
细胞与基因治疗(CGT)产业链覆盖了从基础研究到临床应用的多个环节,其分为上游、中游和下游三部分。上游主要集中在技术与材料的研发,是整个产业链的基础阶段。在这一环节,细胞与基因治疗所需的原材料和核心技术尤为关键,包括患者或供体来源的自体或异体细胞资源,以及干细胞、免疫细胞(如T细胞、NK细胞)等。基因编辑工具(如CRISPR-Cas9、TALENs)和基因递送载体(如腺相关病毒AAV、慢病毒或脂质纳米颗粒)也属于这一部分。同时,细胞培养设备、生物反应器、基因编辑仪器等关键设备为基础研究提供了技术保障。此外,合同研发组织(CRO)和实验室技术服务公司通过外包形式,为CGT企业提供基因构建、细胞改造、病毒载体生产等技术支持,进一步完善了上游产业链。
进入中游阶段,CGT的核心环节是治疗产品的研发与制造。这一环节包括细胞治疗产品(如CAR-T细胞、干细胞)和基因治疗产品(如基因编辑药物)的开发。研究团队通过设计临床试验,验证这些疗法的安全性和有效性,同时优化生产工艺以实现标准化生产。例如,病毒载体的规模化生产、细胞的大规模培养与扩增,以及生产流程的自动化改进,均是当前中游企业的研发重点。中游企业通常拥有符合GMP标准的生产基地,以确保治疗产品在临床和商业化中符合药品监管要求。
下游环节则专注于产品的市场化与服务。医院和专业医疗机构在这一阶段承担重要角色,为患者提供细胞采集、治疗输注以及后续的健康监测。同时,CGT产品需要通过药品销售渠道覆盖更多医疗机构,并结合定制化治疗方案满足个体患者的需求。患者教育和医保支持也是下游环节的重要组成部分,通过向患者和医生普及CGT知识、推动医保体系覆盖以及设计按疗效支付的模式,可有效降低患者的经济负担。此外,下游还涉及药品审批和政策支持环节,与FDA、EMA等监管机构的沟通对于药物的注册和上市至关重要。
中国细胞与基因治疗在20世纪90年代已有临床研究,至2005年有两款针对实体瘤的CGT产品,但是之后几年热度消散,直到2010年后细胞治疗开始受到各大药企及研发机构的青睐。2016年,魏则西事件一度导致一些细胞免疫管线研发进展滞后,然而随着相关技术指导与监管体系的完善,CGT发展迅速,大量CGT产品进入临床试验,生物技术公司争相布局CGT产业,复星凯特的阿基仑赛注射液于2021年6月获得NMPA批准,成为中国首款上市的CAR-T产品。
睿兽分析整理近年来相关公司的融资情况,细胞与基因治疗融资事件数量从2019年的43起逐年增加,在2021年达到峰值79起,随后下降,到2023年上升至52起,又再度下降,2024年的数据截止目前仅为14起。融资金额与事件数量的波动大致一致,不同的是融资金额于2020年达到峰值。
二、相关企业
唯可生物
上海唯可生物科技有限公司成立于2021年3月,是符合国内监管需求开展整合病毒插入位点分析(ISA)的创新性企业,在基因治疗安全评价领域处于行业领先地位。公司主要致力于基因治疗插入突变风险评估、高精度crispr/cas9定量脱靶分析、载体拷贝数(VCN)、载体质量控制、免疫组库分析和高效sgRNA筛选等方向的技术开发和服务,主营业务为基因治疗插入突变风险评估、高精度crispr/cas9定量脱靶分析、sgRNA筛选等。所依托的LTA-PCR和TES体系为全球第一个经过验证的ISA检测方法,已完成多项FDA及EMA过审基因治疗药物插入突变风险评估。
唯可生物专注载体整合位点(ISA)研究和安全性评价工作20余年,全球范围内参与超过80项基因治疗产品的非临床和临床研究,协助完成多款明星产品的上市申报工作,包括全球第一款基因治疗产品Glybera、全球第一款CAR-T产品Kymriah、中国首款FDA审批通过的CAR-T药物CARVYKTI等超过80%的FDA上市产品。唯可生物的核心技术体系LAM-PCR、S-EPTS/LMPCR、TES,在细胞和基因治疗安评和生物育种等众多领域发挥巨大应用潜力。
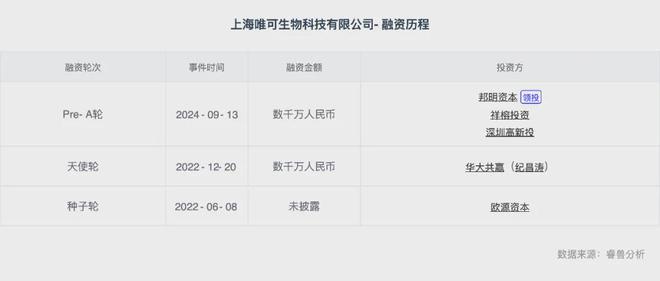
今年9月,唯可生物科技有限公司完成数千万Pre-A轮融资,由邦明资本领投,祥榕投资与深圳高新投跟投。本轮融资将助力唯可生物加速推进细胞和基因治疗安评技术平台、生物育种检测技术平台开发和升级,海外业务拓展等工作。22年12月,其宣布完成数千万天使轮融资,由华大共赢独家投资。本轮融资将助力唯可生物加速技术升级和团队建设,推进细胞基因治疗行业、基因编辑育种行业安全性评估等检测业务扩展,以及实验室平台自动化建设。
贝斯生物
珠海贝斯昂科科技有限责任公司成立于2021年4月,专注于研发新型基因编辑NK细胞治疗产品及基因治疗产品,开发了有专利保护的,且在全球具备FTO(可自由实施,FredomToOperate)的AccuBase碱基编辑系统,可以实现体外和体内高效的基因编辑且零脱靶,此外还开发了高效的先导编辑技术ePE。
贝斯生物的创始团队成员早年从斯坦福大学医学院、贝勒医学院、MDAnderson癌症中心等生物医学科研机构博士毕业后,分别在基因编辑,NK细胞,免疫细胞研发和CMC,运营管理,临床和投融资等领域有20到30年的经验,成功负责过中美多个免疫细胞产品的IND和NDA。公司拥有一系列碱基编辑(BaseEditing)和先导编辑(PrimeEditing)的专利技术,开发了近200个碱基编辑工具,可以满足大多数应用场景的需求。
今年9月,贝斯生物宣布完成A+轮融资,融资金额达数千万人民币。据悉,本轮融资由戈壁大湾区领投,资金将用于加强贝斯生物的研发团队、优化产品管线、加速临床试验,并为未来的商业化奠定坚实的基础。23年1月,其宣布完成了数千万美元A轮融资,由香港GreatEagleVC领投,BV百度风投、广大汇通、火花创投SPARKVC与信熹资本跟投,现有股东弘晖基金持续追加投资。该轮融资将用于推进公司包括通用现货型Super-NK产品和体内编辑疗法在内的多个碱基编辑治疗管线进入IND申报和临床试验阶段,并持续发挥公司碱基编辑底层专利工具和先导编辑专利工具的优势,不断拓宽合作应用场景。

愈方生物
上海愈方生物医药科技有限公司成立于2021年3月,是一家靶向端粒机制的基因治疗药物开发企业。基于团队过往在斯坦福的前沿研究,愈方生物搭建了国际领先的新一代端粒精准调控技术平台,专注于解决心力衰竭等未满足的临床需求。
目前心力衰竭一线临床用药方案以肾素-血管紧张素系统阻滞剂、β受体阻滞剂、醛固酮受体拮抗剂和SGLT-2抑制剂等为代表,主要通过调节神经内分泌系统来降低心脏功能代偿引起的全身性副作用,却无法阻止心衰的持续进展。端粒功能障碍是心衰进展的一个重要环节,最终导致线粒体生物发生减少和凋亡。愈方生物基于能量代谢调节的创新机制,开发的端粒保护蛋白可以阻断端粒损伤-线粒体功能障碍的恶性循环,从而促进心肌功能的恢复。
根据工商信息显示,今年3月,愈方生物完成未披露金额的天使+轮融资,投资方包括金浦投资、夏星投资、江北科投等。23年8月,愈方生物宣布完成数千万元天使轮融资,本轮融资由上海生物医药基金领投,金浦投资跟投。

三、热点讯息
2024年11月,单次注射,基因编辑将致病蛋白一年持续降低90%!NEJM:“淀粉心”迎来新疗法
近期,《新英格兰医学杂志》(NEJM)公布了一项具有里程碑意义的临床研究,该研究采用Nex-z治疗ATTR-CM,并展示了CRISPR-Cas9基因编辑技术在治疗ATTR-CM方面的重大进展。Nexiguranziclumeran(Nex-z)是一种创新的体内CRISPR-Cas9基因编辑疗法,其作用机制是特异性地靶向肝脏中的TTR基因,并通过精确编辑该基因,从源头上减少TTR蛋白的合成,从而降低淀粉样物质在心脏及其他器官的沉积。

2024年11月,100%晚期癌症患者应答,近80%患者达完全缓解!创新CAR-T疗法亮眼结果公布
11月6日,吉利德(Gilead)旗下Kite公司与Arcellx宣布将在今年的美国血液学会(ASH)年会当中,公布其联合开发BCMA靶向CAR-T细胞疗法anitocabtageneautoleucel(anito-cel)用于治疗复发或难治性多发性骨髓瘤(RRMM)患者的临床试验最新结果。目前公布的摘要结果显示,接受anito-cel治疗患者的总缓解率(ORR)高达100%,完全缓解/严格完全缓解(CR/sCR)率近80%,且未在患者中观察到某些迟发性神经毒性的案例。
2024年8月,今年全球已有8款细胞及基因疗法获批,癌症患者有望实现临床治愈
8月,据人民日报健康客户端发布的一则报道中提及,2024年上半年全球已有8款细胞及基因疗法获批上市,从而引发大众关注。细胞和基因疗法作为医学的新前沿,正表现出巨大的潜力和发展势头,特别是在治疗难治性疾病方面,越来越多细胞和基因疗法临床试验被开启。
2024年7月,里程碑:体内制造CAR-T疗法首次进入人体临床试验
7月9日,InteriusBioTherapeutics宣布,已获得澳大利亚治疗用品管理局(TGA)的人类研究伦理委员会(HREC)批准和临床试验通知(CTN)许可,以进行其在研体内CAR-T疗法INT2104的临床1期试验,用以治疗B细胞恶性肿瘤。Interius计划在2024年第四季度开始试验,并有望在2025年第一季度实现关键里程碑。据悉,这项临床1期试验是首个进入人体临床试验的体内CAR-T疗法。
2024年6月,体内基因疗法可以重复给药?一项临床概念验证表示“可以”
当地时间2024年6月25日,由2020年诺贝尔化学奖得主詹妮弗·杜德纳创立的Intellia公布CRISPR/Cas9基因编辑疗法NTLA-2001的最新临床数据。三位先前在I期剂量递增研究中接受最低剂量NTLA-2001治疗的转甲状腺素蛋白淀粉样变性患者,在接受后续55mgNTLA-2001治疗后,其血清转甲状腺素蛋白水平中位减少90%。Intellia在新闻稿中称,这是显示体内CRISPR/Cas9基因编辑疗法可有效重复给药的首个临床数据,表明体内基因编辑重复给药完成概念验证。
