转自:生物谷
抗氧化剂一直被视为守护我们身体免受自由基侵害的“超级英雄”。其中,迷迭香酸(Rosmarinicacid,RA)作为一种备受瞩目的天然抗氧化剂,广泛存在于多种植物中,如迷迭香、留兰香等,因其具有抗炎、抗癌、抗菌等诸多益处而被广泛应用于健康产业。
然而,GenesandEnviron近期一项研究“Rosmarinicacid,anaturalpolyphenol,hasapotentialpro-oxidantriskviaNADH-mediatedoxidativeDNAdamage”却揭示了RA可能隐藏的“另一面”——在特定条件下,它竟然有可能通过NADH介导的氧化应激对我们的DNA造成损伤。这一发现无疑给我们敲响了警钟,让我们重新审视RA的安全性。
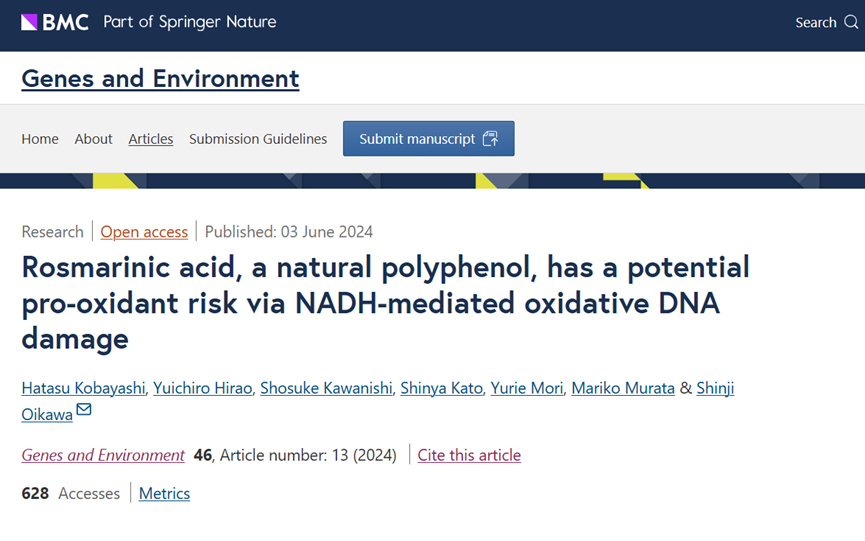
为了明确RA氧化DNA损伤的机制,研究团队利用分离的DNA,在金属离子存在的情况下,对RA及其类似物异迷迭香酸(isorinicacid)诱导的DNA损伤进行了深入分析,采用高效液相色谱(HPLC)系统结合电化学检测器(ECD),测量了小牛胸腺DNA中8-oxodG的形成,以此作为氧化损伤DNA的指标。同时,使用32P-5'-端标记的DNA片段,研究了RA与Cu(II)诱导的DNA损伤及其位点特异性。
实验结果
1.RA与金属离子及NADH共同作用下8-oxodG的形成
研究发现,在小牛胸腺DNA中,RA与Cu(II)共同作用时,8-oxodG的形成显著增加,且呈现浓度依赖性。而RA与Fe(III)共同作用时,几乎不增加8-oxodG的形成。当加入内源性还原剂NADH时,RA与Cu(II)诱导的8-oxodG形成显著增强,在低浓度RA(0.1-0.5μM)时,增强效果约为30倍。RA类似物异迷迭香酸与Cu(II)共同作用也能增加8-oxodG水平,但其诱导量仅约为RA的一半,NADH同样增强了异迷迭香酸诱导的8-oxodG形成。
2.RA与Cu(II)对32P-标记DNA片段的损伤作用
通过对32P-5’-端标记的DNA片段分析,研究人员发现,在Cu(II)存在的情况下,RA以浓度依赖的方式导致DNA断裂,而哌啶处理进一步增强了这种断裂效应。这表明RA与Cu(II)不仅引起了DNA链的断裂,还导致了碱基的修饰。
3.ROS清除剂和Cu(I)螯合剂对RA与Cu(II)诱导DNA损伤的影响
为了确定导致氧化DNA损伤的活性氧物种(ROS)类型,研究团队测试了多种ROS清除剂和Cu(I)螯合剂的作用。结果显示,过氧化氢酶(H2O2清除剂)和浴铜灵(Cu(I)螯合剂)能够抑制RA与Cu(II)诱导的DNA损伤。而典型的・OH自由基清除剂(如乙醇、甘露醇和甲酸钠)则无抑制作用,不过甲硫氨酸(可清除除・OH外的多种ROS)能够阻止DNA损伤,超氧化物歧化酶(SOD)同样未表现出抑制效果。这些结果表明,H2O2、Cu(I)和除・OH外的ROS参与了RA与Cu(II)诱导的DNA损伤。
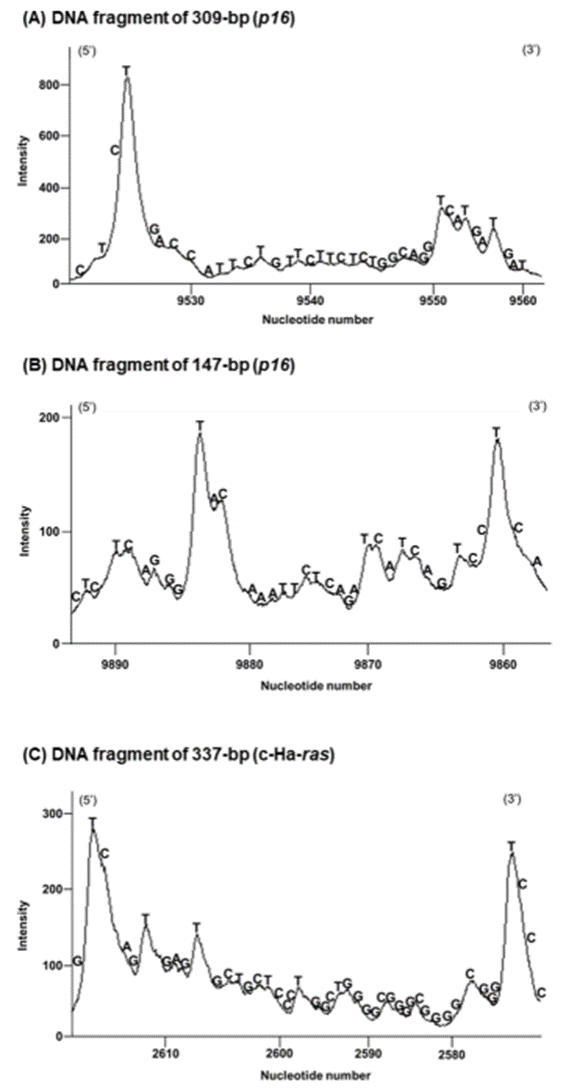
4.RA与Cu(II)诱导DNA损伤的位点特异性
利用Maxam-Gilbert测序法,研究人员确定了RA与Cu(II)诱导的DNA损伤模式。结果表明,RA与Cu(II)主要在来自人类p16肿瘤抑制基因和c-Ha-ras-1原癌基因的DNA片段中的胸腺嘧啶(T)和一些胞嘧啶(C)残基处诱导DNA断裂,尤其是在哌啶处理后。由于・OH导致的DNA断裂通常没有明显的位点特异性,因此RA与Cu(II)诱导的DNA损伤位点特异性提示除・OH外的ROS参与了这一过程。
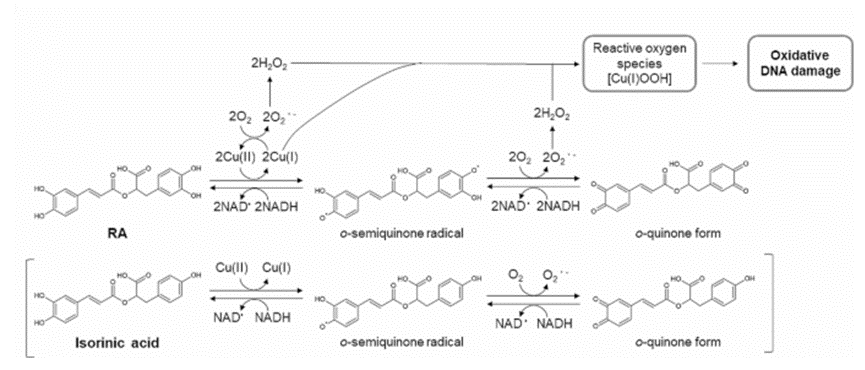
结果讨论
本研究揭示了RA在Cu(II)存在下通过氧化还原循环反应诱导DNA损伤的机制。RA的儿茶酚基团在Cu(II)介导下发生自氧化,生成相应的半醌自由基和醌形式,同时Cu(II)被还原为Cu(I),并产生超氧阴离子自由基(O2-),后者歧化为H2O2。随后,Cu(I)与H2O2形成复合物(可能是Cu(I)-氢过氧化物),从而诱导氧化DNA损伤。NADH可能将醌和半醌自由基再次还原为RA,进一步增加ROS的生成,加剧氧化DNA损伤。
临床试验中,参与者每日摄入含200–500mgRA的植物提取物,人体血清中RA的最大浓度可达约0.16μM。本研究发现,0.1μM的RA在生理相关浓度的Cu(II)(20μM)和NADH(100μM)存在下即可诱导氧化DNA损伤,这表明RA的使用,尤其是在治疗用途中,可能在体内导致氧化DNA损伤。尽管当前实验条件下RA与EDTA-Na-Fe(III)未对分离的DNA造成损伤,但细胞生物学和计算研究提示RA可能引起铁介导的ROS生成,因此铁在RA诱导的体内氧化DNA损伤中可能也发挥作用,未来还需利用细胞和动物模型进行深入研究。
综上所述,本研究表明RA可通过与铜和NADH的氧化还原循环反应诱导Cu(I)-氢过氧化物形成,进而导致氧化DNA损伤。NADH对氧化DNA损伤的显著增强作用提示,在评估多酚的促氧化活性时,需要特别关注其与内源性还原剂的相互作用。这一研究强调了在考虑RA潜在治疗应用时,进一步研究其促氧化和遗传毒性风险的必要性,为RA在医药领域的安全应用提供了重要的理论依据。
参考文献:
Kobayashi,H.,Hirao,Y.,Kawanishi,S.etal.Rosmarinicacid,anaturalpolyphenol,hasapotentialpro-oxidantriskviaNADH-mediatedoxidativeDNAdamage.GenesandEnviron46,13(2024).https://doi.org/10.1186/s41021-024-00307-7
(转自:生物谷)
