转自:生物谷
文章解读+创新点拓展,为您带来科研新体验~
导读
随着单细胞测序技术和类器官培养技术的发展,科学家们对复杂生物系统的理解达到了前所未有的深度。近期,由张旭、吴倩和王小群领导的研究团队在《Cell》上发表了一篇重磅论文《Decodingtranscriptionalidentityindevelopinghumansensoryneuronsandorganoidmodeling》,通过构建人类胚胎期背根神经节(DRG)的时空发育图谱,开发了模拟人类DRG发育的类器官系统,揭示了感觉神经元分化的路径和调控机制。这项研究不仅加深了我们对神经系统发育的认识,也为未来临床治疗开辟了新的途径。
研究背景
感觉神经元是传递触觉、温度、疼痛等感觉信号的重要媒介。了解这些神经元如何从干细胞中分化而来,对于探索神经系统疾病的发生机制及开发相应的治疗方法至关重要。然而,由于伦理和技术限制,直接研究人体内感觉神经元的发育过程一直是一个巨大的挑战。本研究利用单核RNA测序(snRNA-seq)和转录因子序列荧光原位杂交(TF-seqFISH)技术,成功绘制了覆盖妊娠早期至中期的人类DRG发育的高分辨率时空图谱,填补了这一领域的空白。
研究设计与结果
研究人员首先收集了来自不同发育阶段的人类胚胎样本,并使用先进的snRNA-seq技术对其进行了全面分析。通过对数万个单个细胞的数据进行处理,他们识别出了多种特定的感觉神经元亚型及其随时间变化的空间分布模式。此外,还建立了一个人工模拟环境下的DRG类器官系统,能够再现体内DRG的发育特征。通过这种方式,研究人员可以在实验室条件下详细观察和操控感觉神经元的分化过程。
为了验证所建立的DRG类器官系统的可靠性,研究者们实施了一系列实验,包括钙成像、基因敲减以及药物抑制实验等。结果显示,这种体外培养系统可以有效地模拟真实组织中的神经元发育情况,并且发现了关键转录因子MEIS2对于某些类型感觉神经元分化的重要性。这些发现进一步证明了DRG类器官作为一种强大的工具,在研究人类神经系统发育方面具有巨大潜力。
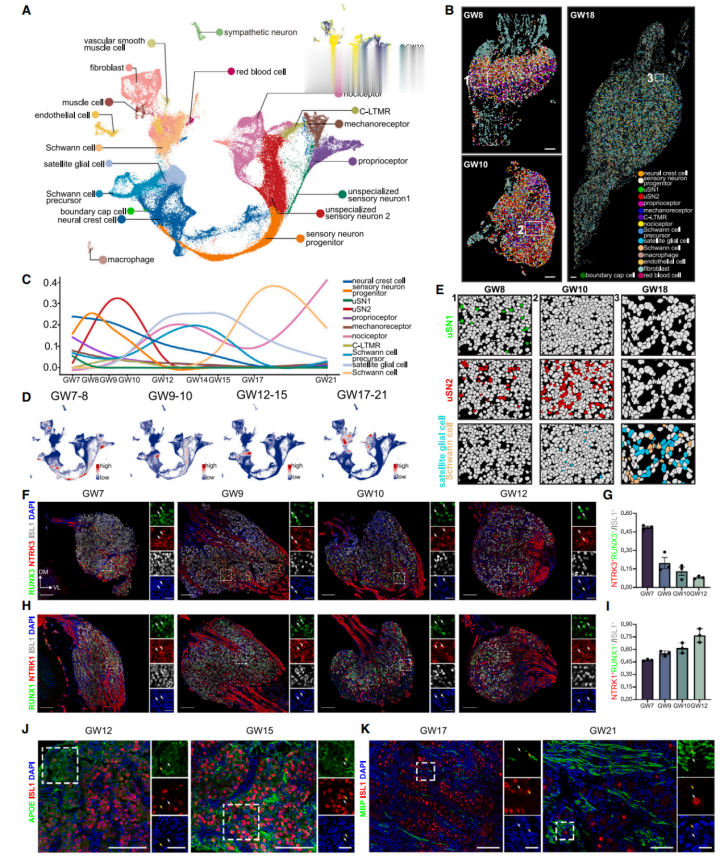
研究人员对妊娠周数(GW)为7-21的DRG样品进行了snRNA测序,观察到相应妊娠阶段样品之间明显的发育连续性和高转录相似性(图1A)。并注释出19个主要细胞簇,这些细胞簇包括来自神经和胶质谱系的前体细胞及其衍生细胞。通过整合TF-seqFISH转录因子与snRNA-seq数据,研究人员分别绘制了GW8、GW10和GW18的全面DRG时空图谱,揭示了在人类DRG发育过程中细胞分化动态变化及空间特征的变化(图1B)。
通过定量分析人类胚胎DRG中主要细胞类型在妊娠阶段的变化,观察到两个明显的神经发生波。第一个波从GW7之前开始,在GW8结束,主要产生本体感受器和机械感受器;第二个波从GW7到GW12,主要产生伤害性感受器和C类低阈值机械敏感受体(C-LTMR)。同时,胶质细胞分化也分为两期进行,施旺细胞(SC)和卫星胶质细胞(SGC)分别在GW12-GW15、GW17-GW21进行分化(图1C、1D)。值得注意的是,GW12是一个关键的转折点,标志着神经嵴细胞(NCC)的命运从神经元向胶质细胞转变。
TF-seqFISH分析进一步揭示了不同细胞类型独特的时空分布:其中一簇未分化感觉神经元(uSN1)仅在GW8观察到,而另一簇未分化感觉神经元(uSN2)则在GW8和GW10均可见。与神经发生阶段(GW10)存在的少量胶质细胞相比,在GW18时,胶质细胞形成一个结构环包围着神经元,表明胶质增殖和分化进入后期阶段(图1E)。免疫荧光染色也验证了单细胞转录谱推断的发育轨迹,显示在GW7时,来源于uSN1的神经元(NTRK3+/RUNX3+/ISL1+,大直径神经元系)和来源于uSN2的神经元(NTRK1+/RUNX1+/ISL1+,小直径神经元系)的比例相当。
然而,到GW12时,uSN2衍生的神经元比例显著增加至76%,而uSN1衍生的神经元比例下降至8%。值得注意的是,在早期DRG发育过程中,NTRK2+机械感受器(一种uSN1衍生细胞类型)的比例始终保持较低水平(图1F-1I)。
为了准确量化SGC,研究人员对SGC-神经元单元进行了计数,反映了卫星胶质生成的动力学过程。在GW12时,有15.4%的神经元被SGCs包围,这一比例在GW15时上升至40.9%。SC首次出现在GW17,并随后逐渐增多(图1J、1K)。
综上所述,这些发现揭示了人类胚胎期早期和中期DRG中细胞特化严格的时间顺序以及不同类型细胞复杂的结构特征。

对NCC衍生细胞分化轨迹分析发现,NCC衍生细胞可以分为感觉神经元前体细胞(SNP)和SC前体细胞(SCP)子类群。SNP进一步分化为uSN1和uSN2亚型,而SCP则进展到分化成SGC和SC(图2A)。
研究者将轨迹变量基因分为九个模块,进一步根据不同的表达趋势进行分组:持续下调、上调后下调、下调后上调和持续上调(图2B)。这些基因模块在不同发育阶段的细胞中富集,调控人类DRG发育过程。
进一步发现了在细胞类型特异性中的各种转录因子的作用(图2C、2D)。通过进行信号通路富集分析发现WNT、MAPK信号通路在NCC中高度富集,RA信号通路在NCC、SNP和uSN1中富集。此外,BDNF和NT-3信号通路在uSN1中富集,NGF信号通路在uSN2中富集(图2E)。除了神经发生分支中RUNX1/3的特异表达外,还发现MEIS2和SKOR2是第一波神经发生的必要条件,该波主要产生大量感觉神经元,而FOXO1在第二波中起主导作用,主要是产生小的感觉神经元(图2F、2G)。
这一发现得到了GW7DRG组织免疫荧光染色结果的支持,结果显示NTRK2/3与MEIS2具有显著共表达(94.6%),以及NTRK2/RUNX3与SKOR2之间具有显著共表达(84.8%)(图2H,2I)。同样地,NTRK1/RUNX1与FOXO1的共表达(33.2%)强调了FOXO1作为第二波神经发生的关键调节因子的可能性(图2J)。
此外,TF-seqFISH数据证实了这些发现,并揭示了一致的RNA共表达模式,强调了uSN1中的MEIS2、SKOR2和RUNX3以及uSN2中的FOXO1和RUNX1的共同表达(图2K,2L)。

第一波神经发育过程中uSN1分化为本体感受器和机械感受器(图3A、3B)。分析发现,从uSN1到本体感受器过渡期间上调的基因与神经肌肉接头有关,参与的转录因子有MEF2A和SMAD9;机械感受器细胞中上调的基因与分化相关,参与的转录因子有DRGX和SHOX2(图3C、3D)。差异性表达分析发现功能基因PIEZO2主要在机械感受器中表达,ASIC1和ASIC2在本体感受器中表达(图3E),表明ASIC阳离子通道在增强本体感受器的机械敏感性方面发挥着重要作用。
研究者进一步探索了潜在的分子调节因子,将三种本体感受器亚型划分为:未特化的本体感受器P-1(NTRK3和RUNX3)、腹侧远端本体感受器P-2(CRTAC1、TCERG1L和PCDH17)以及背侧远端本体感受器P-3(CDH13、ETV1、TACR3和ITGA2)(图3F、3G),表明本体感受器神经元的早期身份确定过程受肢体间充质信号的影响。
对于机械感受器,研究人员识别出几种不同的亚型:未特化的机械感受器(NTRK3、NTRK2和SHOX2),Aβ纤维快适应低阈值机械感受器(AβRALTMR;RET,GFRA2,MAFA和NTRK2-low),Aβ纤维慢适应低阈值机械感受器(AβSALTMRs;NTRK3和NTRK2-high),以及AδLTMR(NTRK2和RET)(图3H、3I)。asmFISH证实了这些特殊本体感觉受和机械感受器亚型在GW18的存在及其定位(图3J)。
研究者进一步使用URD和SCENIC分析来确定分化轨迹的调节基因,发现ETV1+、NPAS2+和MEF2C+在背侧远端本体感受器中占主导地位,并且NFIA和PKNOX2在腹侧远端本体感受器表达显著(图3K)。这些发现表明,在不同的外源信号和转录因子组合在非常早的阶段就开始影响本体感受器的细胞身份和功能发育。此外,研究人员还还识别出不同机械感受器亚型富集的调控子(图3L)。
这些结果突出了TF在塑造机械感受器功能多样性的关键作用,以及皮肤类型依赖性机械感受器发育特征的作用。
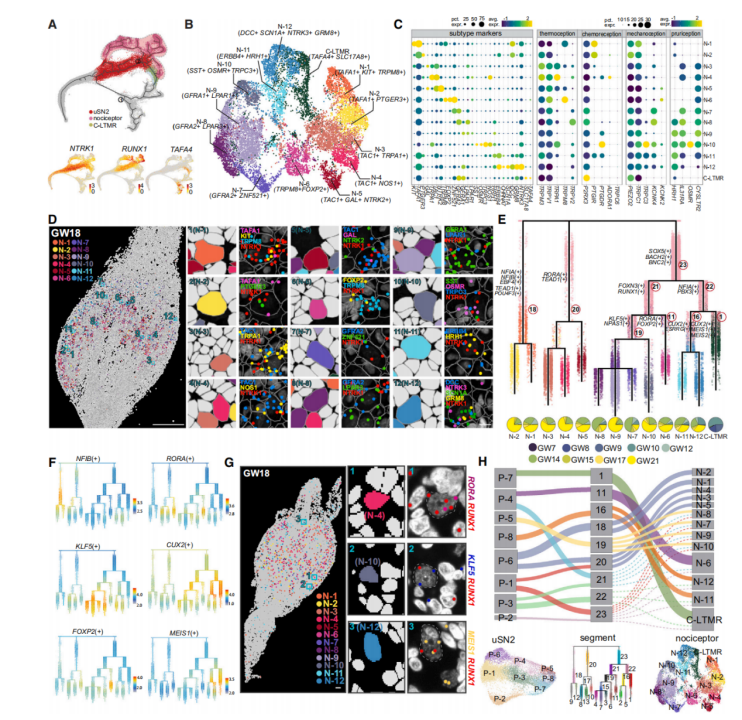
第二波神经发生启动了C-LTMR和伤害感受器的发育(图4A)。将uSN2衍生的神经元分为13个亚型,包括12种伤害感受器亚型和C-LTMR,每个亚型都由独特的离子通道、受体和已知的伤害感受器特异性标记物定义(图4B、4C左)。某些伤害感受器亚型表达多种感觉受体(图4C右),比如N11和N12都是NTRK3+伤害感受器,它们表达CHRNA7、GRM8、SCN1A、HRH1和TRPV1受体,表明其在多模式疼痛过程中的作用(图4B、4C)。asmFISH证实了这种表达模式,证明了这些不同类型的伤害感受器在发育过程中存在(图4D)。
在确定了伤害感受器细胞类型后,分化轨迹分析(图4E、4F)显示uSN2s中的一个分支被分为不同的亚群,这些亚群与伤害感受器亚型相关联。每个分支具有独特的调节子谱系特征。利用TF-seqFISH数据确认了相应伤害感受器亚型中RUNX1与这些特异性转录因子的表达类型,共同调节亚型多样性(图4G)。
由于在URD树中观察到uSN2的早期分离后,研究人员对uSN2进行了无监督聚类,产生了8个异质性亚组(uSN2-1到uSN2-8),每个亚组都显示出与特定的神经元亚型的强关联(图4H)。这些发现表明,从uSN2亚型衍生出的感觉神经元的命运限制可能发生在早期、未特化的阶段。

在NCC分化为胶质细胞的过程中,出现了一种中间状态的SCP,能够同时向SC和SGC分化(图2A)。研究者使用树状图来追踪从SCP(CDH19+/CDH6+)到成熟SGC(APOE+)和SC(PMP22+)的胶质细胞谱系轨迹(图5A)。分析关键转录因子和基因的时空表达模式揭示了与SGC相关的基因比与SC相关的基因更早被上调,也表明SGC分化先于SC形成(图1C、1D及5B)。GO富集分析显示,在主要表达于SGC和SC中的基因参与了细胞迁移和神经功能成熟等过程(图5B)。
为了进一步阐明感觉神经元和胶质细胞之间的细胞相互作用,使用了CellChat分析,并将配体受体(LR)对分为14种不同的模块(LR1-LR14),以揭示不同细胞类型之间通信的特定LR信号通路(图5C)。神经-胶质单元的形成由外源性基质分子和特异性细胞表面受体介导,如纤连蛋白、胶原蛋白以及Semaphorin家族超家族成员(图5D)。
值得注意的是,在各种感觉神经元亚型中识别出独特的LR对。例如,LR9特征是LRRC4C与NTNG1的相互作用,分别富集在SGC和机械感受器中。此外,SGC表达SLIT2/3,它们专一地结合到痛觉感受器中的ROBO2(LR10),而SGC中表达的SEMA4B可以特异地结合到本体感受器中的DCBLD2(LR11)(图5E)。这些细胞类型的特殊胶质-神经元相互作用通过单细胞空间转录组数据进一步得到证实,表明周围SGC在促进神经元特异功能方面可能发挥专门的作用(图5F)。
巨噬细胞对于免疫相关病理条件下疼痛感受器的激活起着关键作用,这些巨噬细胞表达ITGAM、CSF1R、PTPRC、MRC1和MERTK的细胞(图5G)。免疫染色显示,在DRG中巨噬细胞招募始于GW10,与第二波神经发生结束的时间一致,表明巨噬细胞可能参与并影响神经发育过(图5H)。巨噬细胞(P2RY12+)和神经元(ISL1+)的比例随着时间推移而增加(图5H、5I)。
为了阐明巨噬细胞和感觉神经元之间建立功能单元的分子相互作用,使用CellChat分析LR相互作用。GO富集分析帮助显示semaphorin-plexin和整合素信号通路在巨噬细胞招募中十分重要。此外,APOE-SCARB1、PTPRC-MRC1和SYK-FCGR2A之间的相互作用可能是巨噬细胞-神经元单位的关键调节因子,提示它们在调控DRG发育中巨噬细胞功能方面的潜在作用(图5J、5K)。
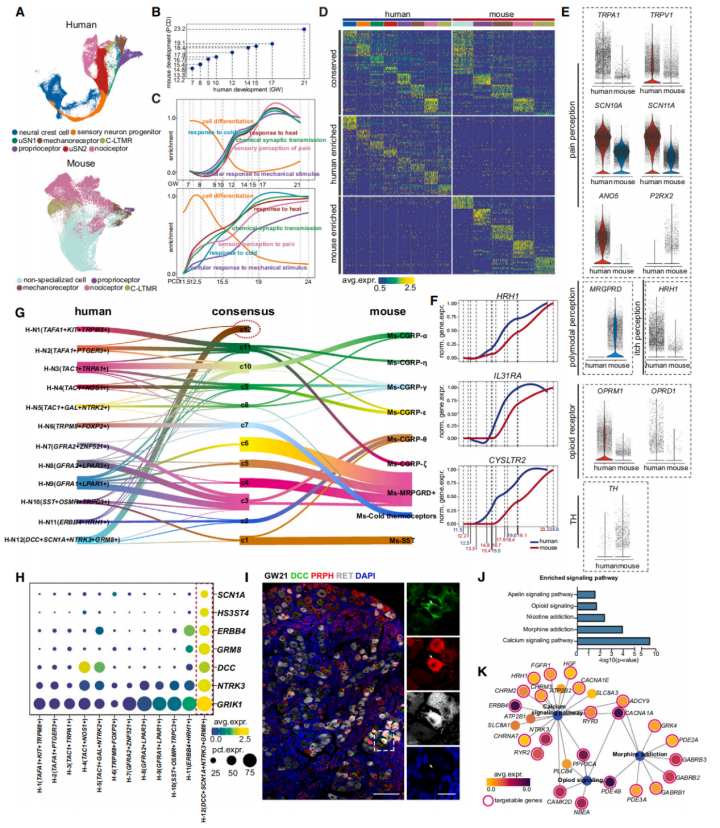
基于先前的数据和研究者的研究分析发现,从妊娠7周到21周的人类胚胎DRG发育过程与小鼠胚胎期第12天(E12)到出生后第4天(P4)的DRG发育进程高度相似(图6A、6B),但存在时间上的差异,进一步分析发现在人类DRG中,细胞分化从妊娠7周至12周明显减少;而小鼠细胞分化在E12.5达峰值并持续下降直至出生(图6C)。TRPA1、TRPV1、SCN10A、SCN11A和ANO5等与疼痛相关的基因的表达水平上在人类中更高;相反,P2RX2在小鼠中的表达水平高于人类。瘙痒感知相关的基因,HRH1,在人类神经元中相对高表达;此外,参与多模态伤害感受过程的MRGPR家族成员MRGPRD未在人类胚胎DRG中表达。阿片类药物受OPRM1和OPRD1的表达水平在人类中较高且范围较广。
此外,TH在小鼠部分感觉神经元中表达,但在发育期的人类DRG中低表达。人与小鼠DRG发育过程中关键基因表达启动时间也有显著差,特别是与瘙痒感知相关的IL31RA、CYSLTR2和HRH1基因,这些基因在人类DRG中早于小鼠DRG表达(图6F)。这些观察结果强调了人类和小鼠DRG中独特的基因表达谱,揭示了感觉系统进化适应的重要见解。
此外,人类N6痛觉神经元类似于小鼠TRPM8+冷热感受器,N10痛觉神经元类似于小鼠SST+神经元,而N11痛觉神经元类似于小鼠CGRP-θ神经元(图6G)。有趣的是,免疫染色结果显示,由RET+特征标记并伴有DCC、SCN1A、NTRK3和GRM8的N12,在基因表达模式上没有明显的差异(图6H、6I)。N12神经元表现出钙信号通路、吗啡和尼古丁上瘾、阿片肽信号通路以及apelin信号通路相关基因的高表达。这些途径中的几个靶点被用于治疗精神疾病和偏头痛(图6J、6K)。
总体而言,这些发现揭示了物种间显著差异的基因表达和感受器细胞类型,在感觉和疼痛过程中起着关键作用。
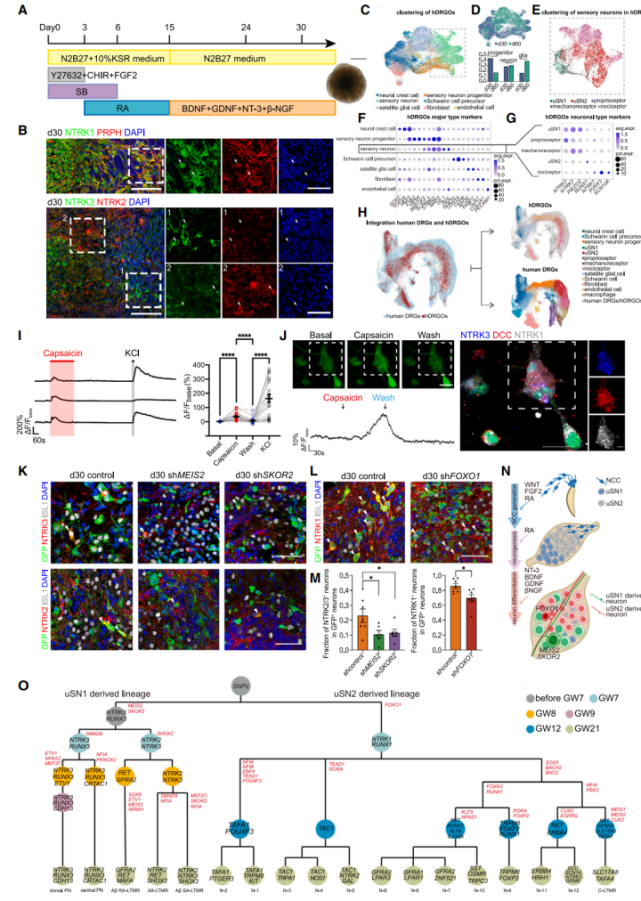
基于先前的研究和对人类脊神经节发育的外源信号和内在转录因子调节的理解,研究者建立了一个稳健的方法来生成准确再现人类感觉神经元发育过程和多样性的人类背根神经节类器官(hDRGO)模型(图7A)。免疫荧光染色显示了各种感觉神经元亚型的存在(PRPH+),包括本体感受器(NTRK3+)、机械感受器(NTRK2+)和痛觉受体(NTRK1+)(图7B)。
结合钙成像和免疫荧光染,证实了hDRGO中存在丰富的DCC+/NTRK3+/NTRK1+人伤害感受器神经元,这些伤害感受器通过响应辣椒素显示伤害特征,表明hDRGO有效地反映了人类伤害感受子亚型的多样性和特异性(图7J)。研究人员在第30天和第60天分别进行了hDRGO的snRNA-seq分析,其中包括NCC、SNP、uSN1、uSN2、本体感受器、机械感受器、伤害感受器、SCP、SGC、纤维母细胞和内皮细胞(图7C,7E-7G)。
在整个hDRGO培养过程中,祖细胞(NCC、SNP和SCP)连续分化并形成复杂的细胞类型(图7D)。hDRGO的细胞组成和转录组与胚胎早期至中期发育阶段(GW7-GW15)表现出相似性(图7H)。
使用慢病毒载体递送靶向MEIS2、SKOR2以及FOXO1的shRNA,以分别抑制hDRGO第一波和第二波神经发生(图2F、2G),结果表明,在FOXO1敲除的类器官中NTRK1+神经元减少,而在MEIS2和SKOR2敲除的类器官中NTRK2+和NTRK3+神经元减少(图7K-M)。这些发现进一步证明MEIS2、SKOR2和FOXO1在uSN1和uSN2的细胞命运决定中起关键作用,也验证了hDRGO对人胚胎DRG发育过程的模拟。
拓展延伸
●疾病建模
1.癌症研究:通过从肿瘤患者的样本中生成类器官,研究人员能够模拟肿瘤微环境,探索癌细胞的行为和反应机制。例如,结直肠癌类器官被广泛用于研究癌变过程、转移机制以及寻找新的治疗靶点。
2.神经系统疾病:脑类器官(如“迷你大脑”)是研究神经发育障碍(如自闭症谱系障碍)、神经退行性疾病(如亨廷顿舞蹈症)的有力工具。这些模型可以帮助科学家理解疾病的分子基础,并测试潜在的治疗方法。
3.遗传病:对于一些罕见或复杂的遗传病,可以从患者来源的诱导多能干细胞(iPSC)培养出相应的类器官,以研究基因突变如何影响器官功能。
●药物筛选与毒性测试
1.药物发现:制药公司利用类器官进行高通量药物筛选,快速评估大量化合物对特定器官的影响。这种方法有助于早期识别有潜力的候选药物,从而加速新药研发进程。
2.个性化医疗:针对个体患者的类器官可以用来测试不同药物的效果,预测患者对特定治疗方案的响应,实现精准用药。
3.安全性评估:相比传统的二维细胞培养和动物实验,类器官提供了更为真实的体内条件模拟,因此更适合于评估药物的安全性和可能产生的不良反应。
●再生医学
1.组织修复:类器官技术有望推动再生医学领域的发展,特别是对于那些难以自我修复的组织,如肝脏、肾脏等。科学家们正在探索将类器官移植到患者体内以促进组织再生的可能性。
2.器官移植:长远来看,如果能够解决免疫排斥等问题,类器官甚至有可能成为人工制造完整器官的基础,解决器官短缺问题。
●基础生物学研究
1.器官发育:类器官为研究器官形成过程中涉及的关键步骤提供了前所未有的视角,包括细胞分化、形态发生及器官特异性结构的建立。
2.细胞间通讯:由于类器官保留了原始组织的复杂性,它们非常适合用于研究细胞间的信号传导网络及其在健康和疾病状态下的变化。
●毒理学研究
化学物质暴露:类器官可用于评估各种化学物质对人体各器官系统的潜在危害,帮助制定更科学的环境保护政策和产品安全标准。
临床应用与展望
本研究所取得的技术成果将有助于推动神经科学领域向前迈进一大步。首先,通过创建高度仿真的DRG类器官模型,科学家们可以在不依赖于动物实验的情况下,更准确地模拟人类神经系统疾病的状态,从而加速新药研发进程。其次,基于此平台开展的基因编辑或CRISPR筛选实验,可以帮助识别出与特定神经退行性疾病相关的致病基因,为个性化医疗提供理论支持。最后,考虑到DRG在慢性疼痛管理中的重要作用,这项研究有望带来全新的治疗策略,比如针对特定类型的痛觉感受器设计特异性药物靶点,实现更加精准有效的镇痛效果。
注:本文旨在介绍医学研究进展,不做治疗方案推荐。如有需要,请咨询专业临床医生。
参考文献
LuT,WangM,ZhouW,NiQ,YueY,WangW,ShiY,LiuZ,LiC,HongB,ZhouX,ZhongS,WangK,ZengB,ZhangJ,WangW,ZhangX,WuQ,WangX.Decodingtranscriptionalidentityindevelopinghumansensoryneuronsandorganoidmodeling.Cell.2024Nov4:S0092-8674(24)01205-4.
(转自:生物谷)
