转自:药明康德
20世纪60年代,美国细胞生物学家LeonardHayflick博士在体外培养细胞时发现细胞分裂次数是有限的。当细胞培养到一定代数的时候,细胞会停止分裂进入一种增殖阻滞状态,这一界限也被称作Hayflick界限。
随后更多的研究发现,Hayflick界限与细胞衰老密切相关:细胞在触及细胞增殖极限后将进入不可逆的周期阻滞,不断走向衰老。衰老细胞通常表现出多种细胞因子表达上调,细胞分泌能力增强(衰老相关分泌表型,SASP)的特征,这些过程加剧了慢性炎症和组织功能退化。因此,细胞衰老被视为推动机体衰老、诱发衰老相关疾病的重要驱动力。
目前,一种可行的抗衰老策略便是衰老细胞靶向疗法,主要包括清除衰老细胞的Senolytics疗法和抑制SASP的Senomorphics疗法。尽管这些策略在延缓衰老和相关疾病方面具有一定疗效,但仍存在不可规避的局限性。例如,在衰老细胞数量较多时,Senolytics可能导致组织损伤;而Senomorphics虽能抑制炎症,但也可能削弱免疫监视功能。
此外,生物技术公司AltosLabs曾提出可通过“部分重编程”对衰老细胞进行干预,这一方法具备将衰老细胞回溯至更早期状态的潜能,但也存在改变细胞特性、效率低下与安全性存疑等不确定因素。因此,科学界亟待开发更加安全且高效的逆转衰老策略。
日前,河南省科学院首席科学家、中科院生物物理所研究员姬广聚团队在《细胞-代谢》(CellMetabolism)发表了一项重磅论文,新研究颠覆了传统观点,首次从科学层面证明了细胞衰老可以被逆转的可能性,并提出了创新的“Senoreverse”逆转衰老策略。

传统观点认为,细胞衰老是一种不可逆的状态,与“细胞增殖极限”密切相关。然而,研究团队通过深入研究发现,细胞自然达到增殖极限并非是导致衰老的关键。真正促使衰老发生的原因是,氧化应激、DNA损伤等多种压力促使细胞提前进入了增殖阻滞状态。此时细胞并没有触及自然状态下的增殖极限,这种过早的衰老发生导致了组织功能衰退和衰老加速。
通过解除这些压力诱导的增殖周期阻滞,研究团队成功使衰老细胞恢复了增殖能力,最大可能地让细胞接近了自然增殖极限。实验结果表明,这一过程不仅可以恢复组织功能,还能显著逆转衰老进程。研究提出的“Senoreverse”策略不仅挑战了“衰老不可逆”的经典概念,也为抗衰老疗法开辟了新的研究方向。
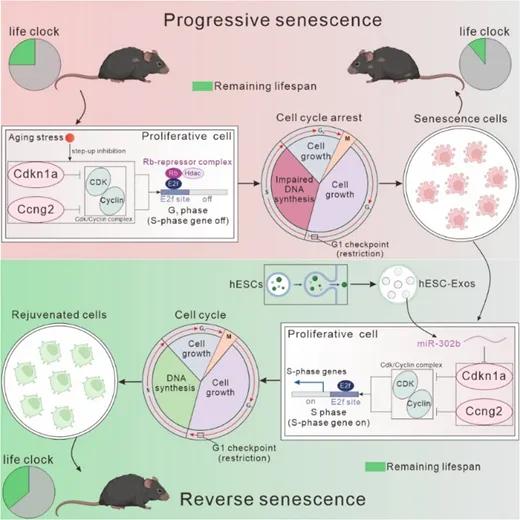
过往研究曾发现,胚胎干细胞来源的外泌体(hESC-Exos)具有帮助组织再生和恢复的作用,其中的丰富蛋白和微小RNA(miRNA)被认为能参与调节衰老和增殖过程。为此,研究团队首先在体外实验中利用hESC-Exos对处于高传代的衰老成纤维细胞进行了干预。结果显示,经过处理后,细胞的许多衰老标志物水平下降,而与增殖相关的指标则明显提升。这表明hESC-Exos可以有效地逆转衰老细胞表型。
此外,研究者发现当衰老细胞接触hESC-Exos之后,与SASP相关的基因也出现了表达水平下调,而与增殖信号通路相关的基因则会上升。根据可视化衰老模型,作者发现hESC-Exos会降低衰老标志物p21-YFP的表达,同时恢复增殖标志物Ki67的水平。相对应的,hESC-Exos让细胞群中处于增殖活跃状态的细胞比例增加,并且“衰老亚群”减少、“年轻亚群”增多。
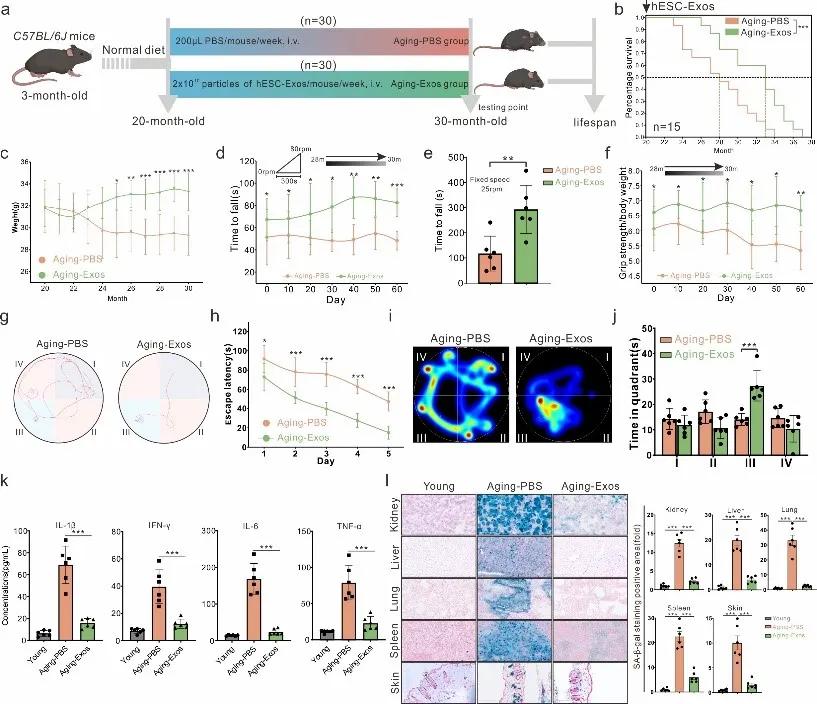
不过,hESC-Exos在体内是否同样具备这种效果呢?为了进一步确认hESC-Exos的作用,研究团队对自然衰老的小鼠进行了hESC-Exos干预处理。他们发现hESC-Exos再次展现出了强大的抗衰老作用:接受干预的小鼠平均和最长寿命得到延长;毛发外观趋于年轻化;运动机能得到了改善,在跑轮、水迷宫任务中表现提升。
分析显示,这些小鼠血清中的促炎因子水平显著下降,组织中衰老细胞标记减少,染色质稳定性标记上调。另外,hESC-Exos在肝脏和皮肤中均能重塑细胞亚群构成,恢复衰老细胞的增殖能力。在衰老组织中高表达的细胞周期阻滞基因显著下调,同时增殖相关基因显著上调。综上所述,hESC-Exos可在体内多维度逆转衰老表型,通过抑制关键细胞周期阻滞因子实现对衰老细胞的“返老还童”。
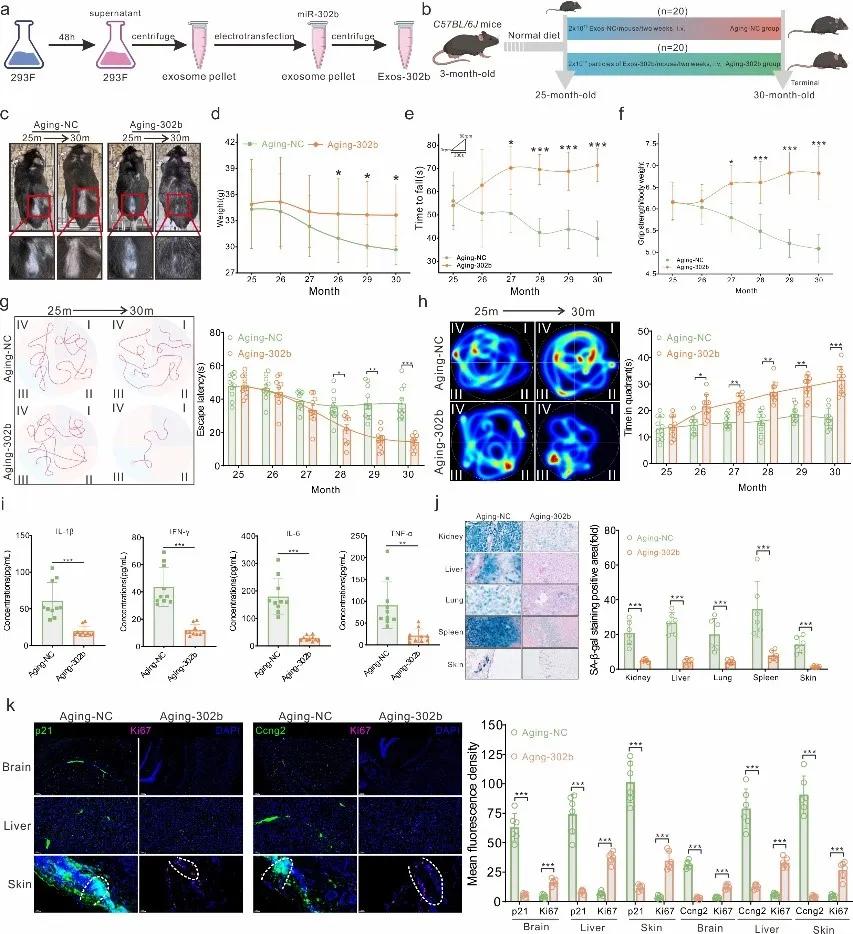
在hESC-Exos的众多蛋白和miRNA中,研究团队发现名为miR-302b的miRNA或是帮助逆转衰老的关键,因为它能够靶向减少细胞周期的抑制因子Cdkn1a和Ccng2。与hESC-Exos的干预效果类似,将miR-302b注射至衰老小鼠体内后,小鼠的毛发外观、体能、学习能力同样得到了显著改善,它们的慢性炎症水平降低,组织中衰老细胞的堆积明显减少。
值得一提的是,miR-302b递送策略具有良好的安全性。在衰老小鼠中持续递送miR-302b不仅显著减缓了衰老引起的体重下降,还在延长小鼠中位、最高寿命的同时降低了死亡风险。长期使用miR-302b也不会增加肿瘤发生率或疾病负担,这些结果支持了miR-302b可以有效且安全地帮助个体抗衰老。
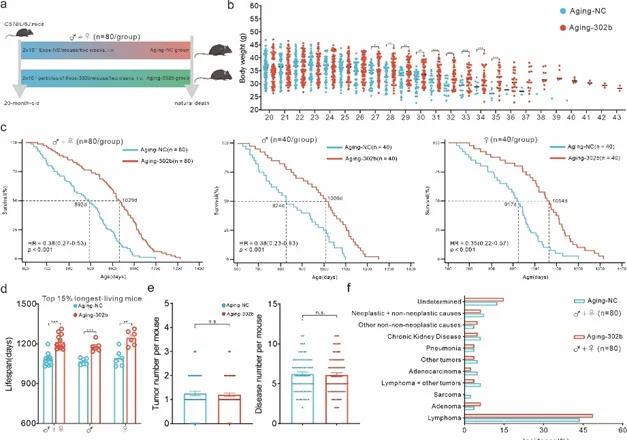
综上所述,本研究首次提出了基于miR-302b的“Senoreverse”策略,颠覆了“细胞衰老不可逆”的经典理论。同时研究验证了miR-302b作为候选“Senoreverse”核酸药物的有效性和安全性。这一研究不仅从理论和实践层面验证了“Senoreverse”策略的可行性,还为衰老相关疾病的治疗提供了全新的方向和解决方案。
中国科学院生物物理研究所特别研究助理(博士后)毕友坤和源生生物科技有限责任公司乔新龙为本文的共同第一作者。河南省科学院首席科学家和中国科学院生物物理研究所研究员姬广聚、中国科学院生物物理研究所研究员薛愿超、上海中医药大学博鳌国际医院教授吴红金为本文的通讯作者。本研究得到了河南省科学院高层次人才科研启动基金、河南省科技研发计划联合基金、中国博士后科学基金会博士后资助项目、国家重点研发计划、国家自然科学基金的资助。
专家点评
高绍荣(中国科学院院士,同济大学生命科学院院长)
本研究创新性地提出了“Senoreverse”逆转衰老策略,通过解除衰老细胞的周期阻滞,实现细胞增殖能力的恢复,开创了抗衰老领域的新方向。相比传统的“Senolytic”和“Senomorphic”策略,“Senoreverse”通过保留衰老细胞而非清除,显著降低了可能的组织损伤或免疫功能削弱风险,展现出更大的临床转化潜力。研究严谨地从体外到体内验证了miR-302b的功能,特别是综合利用多种手段分析揭示了其靶向细胞周期抑制因子的分子机制。长期实验数据表明,miR-302b不仅显著延长小鼠寿命,还在24个月的观察期内保持较高安全性。这为其作为抗衰老核酸药物奠定了坚实基础。未来研究可进一步探索miR-302b在非增殖细胞(如神经元)中的作用,及其是否通过表观遗传调控等间接增强细胞功能。此外,与其他抗衰老因子的联合应用亦值得关注,以提升多器官修复能力。综上,“Senoreverse”策略为衰老相关疾病的干预提供了革命性思路,同时为核酸药物的研发和应用开辟了新领域,具有重要的学术价值和临床前景。
AndrewR.Marks(美国国家科学院院士,哥伦比亚大学生理学与细胞生物物理系主任)
Thisgroundbreakingstudyintroducestheinnovative"Senoreverse"strategy,whichreversesproliferativearrestinsenescentcellswithoutalteringtheirintrinsicproperties.UnliketraditionalapproachessuchassenescentcellclearanceorSASPsuppression,"Senoreverse"mitigatestherisksoftissuedamageandimmunesuppression,addressingcriticallimitationsincurrentanti-agingtherapies.
TheidentificationofmiR-302basatherapeuticcandidateisparticularlyremarkable.BytargetingkeycellcycleinhibitorsCdkn1aandCcng2,miR-302brestoresproliferativecapacityinsenescentcells,significantlyextendinglifespanandimprovingphysiologicalfunctioninagingmice.Thestudy’suseofadvancedtechniquessuchasAgo2Clip-seqandsingle-cellRNAsequencingprovidesdeepinsightsintothemechanismsunderlyingsenescencereversal,whilelong-termsafetyassessmentsconfirmmiR-302b’snon-tumorigenicprofile.
Thisresearchredefinestheparadigmofirreversiblecellularsenescenceandrepresentsamilestoneinagingscience.Theinnovativefindingspavethewayfornucleicacid-basedtherapiesandofferapromisingdirectionforcombatingagingandage-relateddiseases.
JurgenHescheler(德国科隆大学神经生理研究所所长,德国干细胞研究协会发起人和主席)
Thestudy,"ExosomalmiR-302brejuvenatesagingmicebyreversingtheproliferativearrestofsenescentcells"presentedbytheexcellentresearchgrouparoundProf.GuangjuJirepresentsagroundbreakingadvancementinthefieldsofagingandregenerativemedicine.ItintroducesmiR-302bdeliveredviahumanembryonicstemcell-derivedexosomes(hESC-Exos)asatransformativetherapeuticapproachtoaddresscellularsenescence,ahallmarkofaging.Hence,itrepresentsamonumentalstepforwardinourunderstandingofagingandcellularrejuvenation.ByelucidatingthemechanismsofmiR-302b-mediatedsenescencereversalanddemonstratingitssystemicbenefits,theauthorshavelaidthegroundworkforanewparadigminagingintervention.TheirinnovativeuseofmiR-302balignswiththegroundbreakingdiscoveriesinRNA-basedtherapiesthatwererecognizedwiththeNobelPrizeinPhysiologyorMedicine2024,emphasizingthetransformativepotentialofmiRNAinaddressingcomplexbiologicalchallenges.ThisworkexemplifiesthespiritoftheNobel-winningresearch,highlightinghowtargetedmolecularinterventionscanrevolutionizehealthcareandimprovequalityoflifeforagingpopulations.
SocietalImplications:Thesocietalimpactofthisresearchisprofound.Agingpopulationsgloballyfaceincreasedhealthcaredemands,andtherapiesthatextendhealthspan,asdemonstratedhere,havethepotentialtotransformgeriatriccare.Byimprovingphysicalandcognitivefunctions,reducingchronicinflammation,andmitigatingsignsofaging,theproposedinterventioncouldalleviatetheburdenofage-relateddiseases,aligningwiththefocusonhealthyaginginregenerativemedicine(Campisietal.,2019).ThisstudyprovidesastrongfoundationfordevelopingmiR-302b-basedtherapeuticinterventionstocombatage-relateddiseasesandenhancehealthspan.ByleveraginghESC-derivedexosomesasadeliverysystem,thefindingspavethewayforclinicaltrialstargetingsenescence-relatedconditionssuchasfrailty,chronicinflammation,andneurodegenerativedisorders,withthepotentialtorevolutionizegeriatricmedicine.
FutureDirections:Severalavenuesforfurtherresearcharisefromthiswork:(i)UnderstandingmiR-302bbiodistributionandmetabolismwillaidinoptimizingtherapeuticregimens,(ii)Investigatingitsroleinnon-proliferativetissuesandinconditionslikeneurodegenerationorcardiovasculardiseasescouldbroadenitsclinicalutilityaswellas(iii)Evaluatingsafetyingeneticallypredisposedmodelswillbecrucialforclinicaltranslation.
Conclusion:Thisstudyrepresentsamonumentalstepforwardinourunderstandingofagingandcellularrejuvenation.ByelucidatingthemechanismsofmiR-302b-mediatedsenescencereversalanddemonstratingitssystemicbenefits,theauthorshavelaidthegroundworkforanewparadigminagingintervention.Theirworkisnotonlyatestamenttoscientificinnovationbutalsoabeaconofhopeforaddressingthechallengesofaginginanincreasinglyelderlypopulation.
付向东(西湖大学生命科学院RNA生物学与再生医学讲席教授)
本研究提出了突破传统认知的“Senoreverse”策略,通过外泌体递送miR-302b逆转衰老细胞的增殖停滞,挑战了细胞周期阻滞不可逆的经典观点。作者利用单细胞转录组学和Clip-seq技术,深入揭示了miR-302b通过靶向Cdkn1a和Ccng2调控细胞周期的分子机制,展现了其恢复衰老细胞功能的潜力。特别值得关注的是,miR-302b在显著延长小鼠寿命的同时,并未增加肿瘤负担,进一步凸显了其临床应用的安全性和可行性。研究同时表明,miR-302b可能通过调控表观遗传机制(如DNA甲基化、组蛋白修饰)间接改善细胞功能,这为未来的深入探索提供了理论依据。未来工作可进一步拓展miR-302b在非增殖细胞(如神经元、心肌细胞)中的作用研究,探索其是否能通过修复衰老过程中损伤的细胞功能,为神经退行性疾病等衰老相关疾病提供全新治疗策略。总体而言,“Senoreverse”策略不仅开辟了抗衰老治疗的新路径,也为RNA生物学在再生医学中的应用提供了重要支持,为衰老相关疾病的精准干预带来了新的希望。
裴端卿(西湖大学讲席教授,中国科学院广州生物医药与健康研究院院长)
本研究通过提出“Senoreverse”策略,首次验证了衰老细胞增殖能力的可逆性,颠覆了传统认为细胞周期阻滞不可逆的理论。研究系统揭示了miR-302b在调控细胞周期中的关键作用,为细胞命运可塑性提供了新的实验支持,并在理论和实践上为抗衰老治疗奠定了基础。相比传统的“Senolytic”和“Senomorphic”策略,“Senoreverse”以恢复衰老细胞功能为核心,避免了清除细胞带来的组织损伤和免疫抑制问题,展现出更温和且可持续的干预优势。通过从细胞模型到动物模型的多层验证,研究严谨地证明了miR-302b的逆转衰老效果,并通过单细胞测序技术揭示其分子机制。尤其值得一提的是,长期递送miR-302b的实验显示其在延长寿命的同时未增加肿瘤负担,进一步增强了其临床应用的安全性。未来研究可关注hESC-Exos中其他潜在因子的作用,以及miR-302b与化学小分子或代谢调节因子的联合应用,以实现更全面的衰老逆转和功能恢复。此外,探索miR-302b在非增殖细胞(如神经元)中的作用机制,或为神经退行性疾病治疗开辟新方向。总体而言,本研究的“Senoreverse”策略为抗衰老干预提供了革命性思路,为核酸药物开发和细胞命运调控研究注入了新的活力,具备高度的学术价值和临床转化潜力。
周斌(中国科学院分子细胞科学卓越创新中心研究员,研究组长)
本研究通过外泌体递送miR-302b逆转衰老细胞的增殖停滞,首次验证了衰老细胞命运的可塑性,具有显著创新性。研究明确展示了miR-302b通过靶向Cdkn1a和Ccng2调控细胞周期的分子机制,为抗衰老治疗提供了全新策略,不仅突破了传统细胞周期阻滞不可逆的理论,也为衰老相关疾病的治疗开辟了新方向。研究的严谨性体现在从细胞模型到动物模型的多层次验证,为miR-302b恢复衰老细胞功能提供了坚实的实验支持。长期实验表明,miR-302b能够显著延长小鼠寿命,改善衰老表型,同时未增加肿瘤负担,进一步凸显了其作为抗衰老核酸药物的临床应用潜力。未来研究可聚焦于miR-302b是否通过表观遗传机制(如DNA甲基化、组蛋白修饰等)调控衰老细胞命运,以及其在不同细胞类型和微环境中的作用。尤其是非增殖细胞的功能恢复,以及miR-302b与炎症因子或细胞外基质的交互作用,均值得深入探索。总体而言,“Senoreverse”策略为逆转衰老提供了新的理论框架,其研究成果不仅推进了对衰老机制的理解,也为抗衰老干预和再生医学领域提供了广阔的应用前景。
参考资料:
[1]Bi,Youkunetal.,ExosomalmiR-302brejuvenatesagingmicebyreversingtheproliferativearrestofsenescentcells.CellMetabolism(2025).DOI:10.1016/j.cmet.2024.11.013
(转自:药明康德)
