在仿制药与原研药的一致性评价中,会通过生物等效性试验来证明疗效无异。其中,T/R比值是最关键的指标,也就是受试制剂(仿制药,T)与参比制剂(原研药,R)的血药浓度之比。理论上,不同药品试验得到的数据是不同的,如果出现反例,就未免令人疑惑。
近日,一位专业人士告诉第一财经,北大核心期刊《中国临床药理学杂志》在2021年和2024年分别刊发了两款参加国家药品集采药品的生物等效性研究论文(《盐酸克林霉素胶囊在中国健康受试者体内的药代动力学及生物等效性研究》和《富马酸丙酚替诺福韦片在中国健康受试者体内的生物等效性研究》),两个研究的T/R比值及其90%置信区间数据完全一致。这到底是研究者数据统计失误还是论文撰写错误?
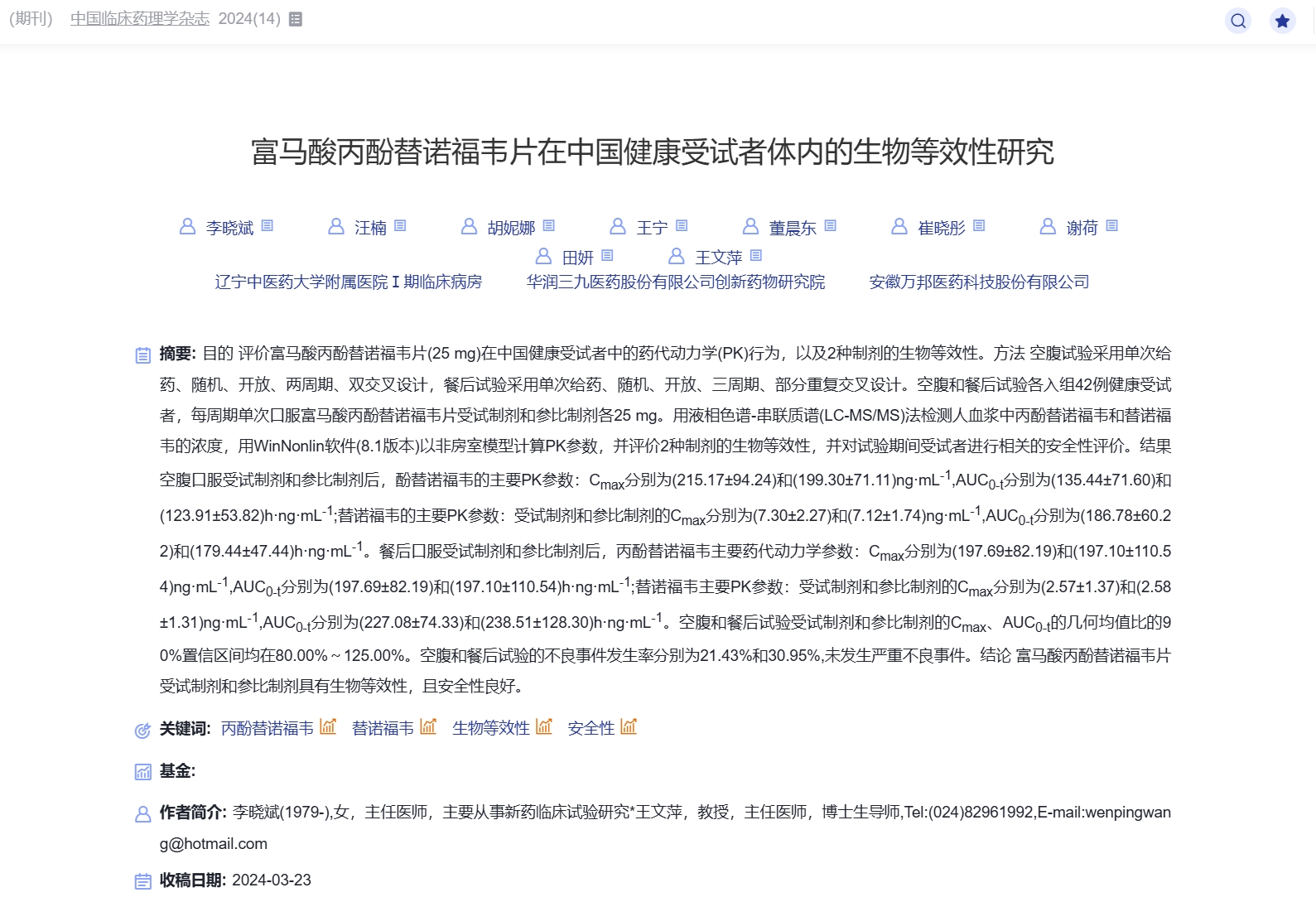
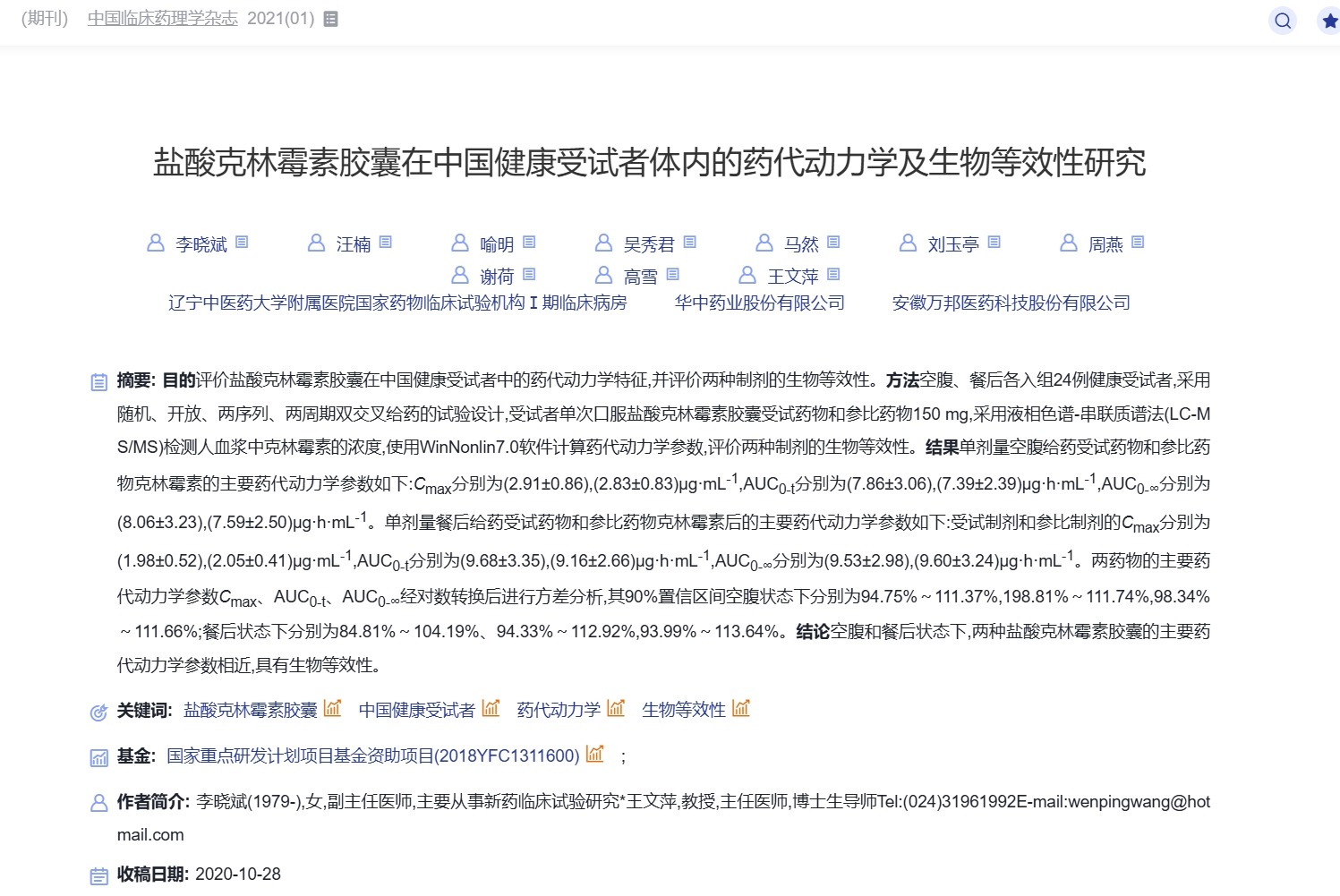
刊发在《中国临床药理学杂志》2021(01)上的《盐》文,是用以评价华中药业股份有限公司的盐酸克林霉素胶囊在中国健康受试者中的药代动力学特征,并评价两种制剂的生物等效性。结果显示,单剂量空腹给药受试药物和参比药物克林霉素的主要药代动力学参数,经对数转换后进行方差分析,其90%置信区间空腹状态下分别为94.75%~111.37%,198.81%~1.74%,98.34%~111.66%;餐后状态下分别为84.81%~104.19%、94.33%~112.92%,93.99%~113.64%。结论为,空腹和餐后状态下,两种盐酸克林霉素胶囊的主要药代动力学参数相近,具有生物等效性。
刊发在《中国临床药理学杂志》2024(14)上的《富》文,是用以评价华润三九医药股份有限公司的富马酸丙酚替诺福韦片在中国健康受试者体内的生物等效性。其研究结果显示:受试制剂/参比制剂Cmax、AUC0-t和AUC0-∞几何均值比值(90%CI)分别为94.00%(84.81%~104.19%)、103.21%(94.33%~112.92%)和103.35%(93.99%~113.64%),均在80.00%~125.00%内。结果表明,两种制剂在空腹和餐后条件下单次口服给药均具有生物等效性。


盐酸克林霉素胶囊为抗生素类药品,适用于由链球菌属、葡萄球菌属及厌氧菌等敏感菌株所致的感染。而富马酸丙酚替诺福片主要用于治疗慢性乙型肝炎、乙型肝炎肝硬化。
“一致性评价的关键是仿制药与参比制剂(一般是对应的原研药)的T/R比值,我国国家药监局和美国FDA的规定是T/R比值的90%置信区间在80%~125%之间则视为具有生物等效性。也就是说,一个生物等效性试验的最关键数据就是T/R比值及其90%置信区间。不同试验的原始数据不同,理应得到的比值和置信区间也不同。不知为何,这两个不同药物的不同试验,虽然原始数据不同,得到的关键比值和区间却是一样的。”发现论文中数据有问题的一位专业人士表示。
而盐酸克林霉素的文献数据,与之前国家药品监督管理局药品审评中心(CDE)公示的数据也一致。富马酸丙酚替诺福片的公示数据,目前官网尚无法查询到。不过,根据华润三九公司官网信息,其产品“富马酸丙酚替诺福韦”(TAF)片获批上市并中选国家集采,该品种注册分类为化药4类(仿制药,视同通过仿制药质量与疗效一致性评价)。根据药监局境内生产药品查询结果,华润三九只有这一款富马酸丙酚替诺福韦片。从国家药监局临床试验平台查询,华润三九也只有这一款富马酸丙酚替诺福韦片进行生物等效性测试(CTR20200796、CTR20200797),该试验的申请人为华润三九医药股份有限公司崔晓彤,亦是上述论文作者之一。
另外一位参与仿制药一致性评价的药学专家告诉记者,90%置信区间的计算值是用数据的均值(受药物的PK行为影响)和标准差(受个体内变异影响)计算的,也就是说如果想要两组数据的90%置信区间完全相同,就需要两组数据的均值和标准差是完全相同的。
“这种情况在药物种类不同时是基本不会出现的。因为富马酸丙酚替诺福韦片和盐酸克拉霉素胶囊的PK及CV相差甚远。而且即使是药物种类相同,这种情况也极难出现。原因是两次试验的人群是不同的,他们的生理状态会有差异或波动。在我们既往一千余个品种的试验中,即使是同一药物重复试验两次,这种情况都从未发生过。这里展示的两篇文章空腹、餐后共产生6个PK参数的90%置信区间,6组数据都完全一致,这种几率是极小的。”上述药学专家表示。
“两篇论文出现数据雷同,有两个环节可能导致,一个是论文审核不仔细,另一个是论文作者写作过程不够严谨。从研究者角度,很难出现相同的数据,因为研究者所收集到的受试者血液样本数据,需要输入一个软件,通过一个计算公式进行计算。两种不同的药物,不太可能出现相同的计算结果。所以,一个可能的原因是,作者在先发表的文章上进行了修改,但这组数据没有被修改过来。”上述药学专家表示。
该专家还指出《盐》文摘要中出现的另一处错误,其90%置信区间数据“198.81%~111.74%”,“198.81%一看就是错误的,可能是98.81%。”
值得注意的是,这两款药品的临床试验均由辽宁中医药大学附属医院和药物研发第三方机构安徽万邦负责。两个试验的负责人均为王文萍、李晓斌。
相关业内人士认为,科学来不得半点虚假,无论是研究者还是登载研究论文的专业出版物。事关生命健康的药品研究数据,更不容半点含糊。此事真相究竟如何,尚待相关部门核查处理。

梦点亮了星星
如果各级领导以身作则 带头吃仿制药 我就支持集采方案 并认为确实是利国利民的大好事
寿山
造假都不会,水平太低
再上征途
事实就是这样[笑着哭][笑着哭]
寿山
都通过了一致性评价
Jay
我们就爱挑战极限,把不可能变成可能[呲牙笑]
杂说
问题要澄清,但通过一些偶发事件来否定仿制药就是动机不良。
迷人的二哥 回复 02-13 16:00
上次数据雷同已经澄清了,数据编辑错误[得瑟][得瑟][得瑟][得瑟]
居无竹 回复 02-13 15:57
你真会扣帽子,你哪只眼睛看见他否定仿制药了?
你说_Vv
中国的论文和申请的专利已经连续十多年世界第一了,论文中的数据有多少是真正通过实验得出的真实数据,写论文的人心里都清楚,评审签字的人和出版编审的人心里也都清楚。 没有接触过写论文发表评审论文的人,只有想一下统计局公布的数据有多少是你认为是正确的或可信的,论文上的数据和结论是怎么一回事就能想明白了。
猫饼子
医疗医药作为民生重中之重大事怎么可以如此草率?集采药品不仅仅是为了给患者节省支出,最重要的是要确保药品疗效,治病救命才最终目的!
党雪莲莲莲
医保局去上海调查了就说质量没问题,不知道啥时候开始药监局不管药品质量了,质量由医保局说了算了[呲牙笑][捂脸哭]
哇哇哇哇
越来越多问题浮出水面!
似温柔亦苍白
仿制药一致性评价的临床研究机构、数据统计分析机构、生物样本检测机构每个环节都可能出现问题!
紫水晶的秘密
连核酸都能外包,其它事就更不可信
醜人_
数据编的他们自己都不信,但是要求老百姓必须相信。
逆风执炬某。
希望纪检监察部门担任裁判。否则没有公平可言
DrewOnly
绝对不可能数据一样,官方的回应是数据编辑错误,但在普遍质疑仿制药质量的时候,应该公开原始数据,要不没办法让人放心
丫头欧洲奢侈品
如果连采集药也造假,那就烂到根了,最后的底线都失守
azmy 回复 02-15 17:23
这个集采药是正规药品,不是假药,就是效果嘛,呵呵
wdkbaby
很一致啊,不然怎么叫一致性评价!
毛线雨等
正好卫健委不知道上海之后该去哪儿呢
圣者仁心
通过不通过 还得看临床的效果……!
egg123
两大部门说仿制药没问题吗?
闪耀琪琪
正大天晴数据19年做的,外企的数据21年做的好了,财经的良心们说说吧,如果是数据造假,是谁家不可靠
少女进化论
大家都知道他们在说谎,他们也知道大家知道他们在说谎,但还是必须说谎!希望有人能出来私底下说一句:该收敛一点了
司徒可乐
国家医保局这次药品集采将成为医保局成立来最大的丑闻!
吧吧啦嘣嘣
看过一篇报道,近百种仿制药的一致性评价数据雷同!连小数点后面两位都一样!曝光后,所有资料都被删除了!
咔咔咔卡哇伊201
去查一下一致性评价的实验,很可能是假的。
噜噜噜噜噜
自已不行,哪就让FDA认证,只有通过FDA认证或欧盟认证的仿制药才允许进入集釆。
小宝
你糊弄我我糊弄你,反正这玩意没有死刑
hz
药品造假。 该死
咕噜咕噜小草莓
最后的底线也突破了。