转自:医药观澜
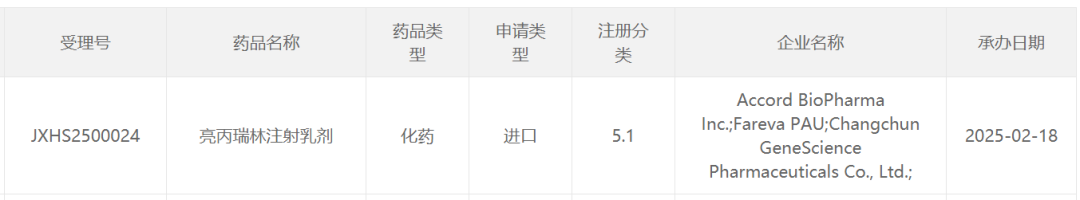
今日(2月18日),中国国家药监局药品审评中心(CDE)官网公示,由AccordBioPharma和长春金赛药业(GeneScience)联合申报的5.1类新药亮丙瑞林注射乳剂上市申请获得受理。公开资料显示,这是一款亮丙瑞林42毫克注射乳剂(商品名为Camcevi),为6个月预充式皮下制剂,只需每6个月皮下注射给药,且可在预先填充的注射器中使用,无需混合。该产品已经在美国、加拿大、欧盟和中国台湾地区等获批上市,用于治疗前列腺癌。根据申报上市的注册分类推测,本次其在中国申报上市的适应症可能为治疗前列腺癌。
亮丙瑞林(leuprolide)是一款促性腺激素释放激素(GnRH)激动剂。GnRH激动剂的潜在适应症涵盖子宫内膜异位症(女性健康);伴有月经过多、下腹痛、腰痛及贫血等的子宫肌瘤(女性健康);绝经前乳腺癌,且雌激素受体阳性患者(肿瘤);前列腺癌(肿瘤);中枢性性早熟症(儿童生长发育)等。
2022年4月,AccordBioPharma宣布与逸达生物科技股份有限公司(以下简称“逸达生物”,ForeseePharmaceuticals)合作,在美国正式推出Camcevi42mg注射乳剂。这款产品于2021年5月获得美国FDA的批准,用于治疗成人晚期前列腺癌。根据此前新闻稿,在一项开放标签、单臂研究中,137名成年人在第0天和第24周接受42mgCamcevi治疗,该产品可在第4周至第48周的初始注射后持续抑制睾丸激素至阉割水平。
早在2020年,长春高新就与逸达生物达成协议,逸达生物将其持有的两个规格的甲磺酸亮丙瑞林产品中国区权益转移给金赛药业。据公告介绍,长效缓释制剂能够增加患者依从性,节省医生和患者的时间。目前临床已有3个月缓释期的亮丙瑞林长效缓释制剂相关产品,而二者合作的甲磺酸亮丙瑞林产品是基于新一代的原位凝胶技术平台,缓释期最高可达6个月。
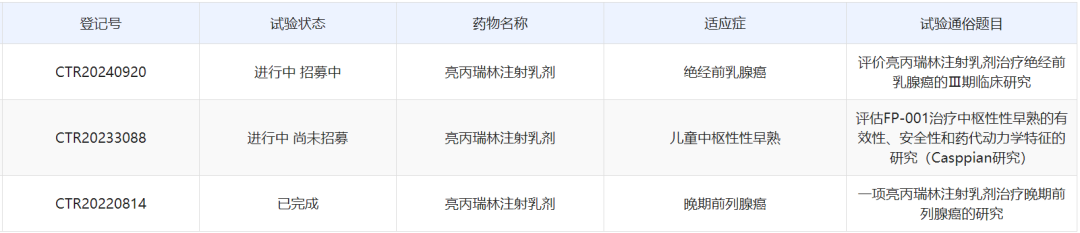
根据中国药物临床试验登记与信息公示平台,逸达生物与金赛药业针对亮丙瑞林注射乳剂开展了至少3项3期临床研究,针对适应症包括晚期前列腺癌、儿童中枢性性早熟、绝经前乳腺癌。其中针对晚期前列腺癌的3期临床研究已经完成。
参考资料:
[1]中国国家药监局药品审评中心(CDE)官网.RetrievedFeb18,2025,fromhttps://www.cde.org.cn/main/xxgk/listpage/4b5255eb0a84820cef4ca3e8b6bbe20c
[2]AccordBioPharma,inPartnershipwithForeseePharmaceuticals,LaunchesCAMCEVI™(Leuprolide)InjectionEmulsionintheU.S.fortheTreatmentofAdvancedProstateCancerinAdults.RetrievedApr4,2022,fromhttps://www.prnewswire.com/news-releases/accord-biopharma-in-partnership-with-foresee-pharmaceuticals-launches-camcevi-leuprolide-injection-emulsion-in-the-us-for-the-treatment-of-advanced-prostate-cancer-in-adults-301516986.html
[3]长春高新技术产业(集团)股份有限公司关于子公司取得台湾逸达公司甲磺酸亮丙瑞林产品相关权益的公告.RetrievedNov18,2020,fromhttp://static.cninfo.com.cn/finalpage/2020-11-18/1208756885.PDF
[4]逸达生物官网.Fromhttps://www.foreseepharma.com/tw/rd/overview
(转自:医药观澜)
