转自:上观新闻
减数分裂是有性生殖生物产生单倍体配子或生殖细胞的特殊细胞分裂方式,是有性生殖的基础。在这一过程中,DNA复制一次,细胞分裂两次,包括减数分裂Ⅰ(MeiosisI,MI)和减数分裂Ⅱ(MII),从而产生单倍体配子或生殖细胞。发生于MI前期的同源重组使来自亲本双方的遗传物质发生交换,增加了物种遗传的多样性,是生物演化的基础;同时,同源重组还能在同源染色体之间建立物理连接,确保它们的精确分离,以维持染色体数量的恒定。因此,减数分裂同源重组是减数分裂过程中最重要的生物学事件。
同源重组起始于程序性DNA双链断裂(Double-StrandBreak,DSB)的形成。早在1997年,就有研究发现Spo11为催化酵母减数分裂DSB形成的关键蛋白;并揭示其在切割DNA双链后,会共价结合在断裂DNA的5'末端。然而,如何在体外表达获得有活性的Spo11,如何在体外重构减数分裂DSB形成过程,长期以来一直悬而未决,被誉为减数分裂同源重组研究领域的“圣杯”。
2月19日24点,国际学术期刊Nature在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)童明汉研究组联合上海交通大学医学院附属新华医院黄旲研究组的最新合作成果:“InvitroreconstitutionofmeioticDNAdouble-strandbreakformation”。该研究在体外表达纯化了SPO11-TOP6BL复合体,解析了它的生化特征,并成功地在体外重构了减数分裂DSB形成。

体外纯化有切割活性的
SPO11-TOP6BL复合体
Spo11是一种高度保守的蛋白,属于IIB型拓扑异构酶家族中拓扑异构酶VI(Top6)家族。Top6是由2个A亚基和2个B亚基构成的异源四聚体,其中,SPO11是具有催化活性的A亚基的同源物,TOP6BL是辅助亚基Top6B的哺乳动物同源物;SPO11和TOP6BL的协同作用为减数分裂DSB形成所必需。
为了解决体外重构减数分裂DSB形成这一难题,童明汉研究组与新华医院黄旲团队合作,利用体外蛋白表达纯化系统成功获得了SPO11-TOP6BL复合体,并首次在体外重现其切割DNA双链的活性。
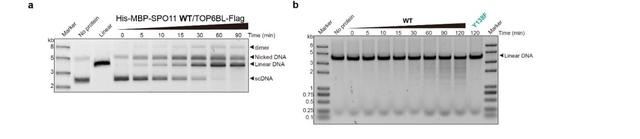
SPO11-TOP6BL在体外能切割DNA
(a)SPO11-TOP6BL对超螺旋质粒的切割实验,随着反应时间增加,质粒逐渐被切割成线性(b)SPO11-TOP6BL对线性DNA的切割实验,随着反应时间增加,长的线性DNA逐渐被切割成不同长度的DNA片段
体外重构减数分裂DSB形成
研究团队采用不同方法,多角度证明了SPO11在切割DNA后,共价结合于切割产物的5'末端。于此,困扰领域近30年的体外重构减数分裂DSB形成难题迎刃而解。

SPO11-TOP6BL切割DNA后共价连接在DNA的5'端
(a)添加SDS不能破坏蛋白和DNA的互作,表明SPO11-TOP6BL切割DNA后共价连接在DNA上(b)对切割产物中SPO11进行IP,成功富集到DNA,表明与DNA共价连接的蛋白是SPO11(c)hTDP2能破坏SPO11和DNA的互作,表明SPO11与DNA的共价连接通过SPO11的Y138残基和DNA的5'端之间形成的5'磷酸酪氨酸键实现
SPO11-TOP6BL
复合体生化特征
随后,研究团队采用凝胶过滤层析、交联质谱、PullDown等方法,系统地研究了SPO11-TOP6BL复合体的生化特征;证实该复合体在溶液中主要以异源二聚体形式存在,只有极少部分能形成异源四聚体。
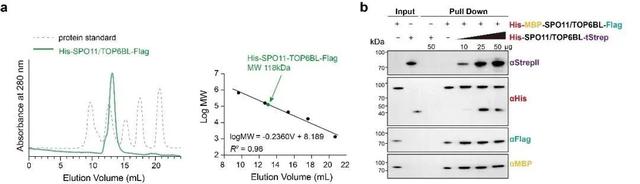
SPO11-TOP6BL在溶液中主要以异源二聚体形式存在
(a)凝胶过滤层析显示SPO11-TOP6BL在溶液中形成稳定的复合体(左),分子量约为118kDa(右),与SPO11(44.6kDa)与TOP6BL(63.8kDa)分子量之和接近,表明SPO11-TOP6BL在溶液中主要以异源二聚的形式存在(b)Pulldown实验显示His-MBP-SPO11/TOP6BL-Flag和His-SPO11/TOP6BL-tStrep之间存在互作,表明SPO11-TOP6BL在溶液中能形成异源四聚体
SPO11-TOP6BL的切割活性依赖Mg2+而不依赖ATP
此外,该研究还发现,SPO11-TOP6BL复合体切割DNA活性依赖于Mg2+,但不依赖于ATP,不同于拓扑异构酶VI活性依赖ATP/Mg2+的特征。更进一步,点突变SPO11的Mg2+结合残基导致SPO11-TOP6BL复合体DNA双链切割活性显著降低;相应的一个Mg2+结合残基点突变小鼠表现为减数分裂障碍,无DSB形成,其表型与Spo11完全敲除小鼠一致。

(a)将SPO11与Mg2+结合的关键残基进行突变(E224Q、D277N和D279N),SPO11的DNA切割活性显著下降(b)SPO11的Mg2+结合残基点突变小鼠(Spo11DN/DN)和对照组(Spo11DN/+)精母细胞核铺展染色,γH2AX(绿色)标记DSB,SYCP3(红色)标记联会复合体侧轴。与对照组相比,突变小鼠的DSB形成受阻(绿色信号变弱)
综上所述,该研究通过体外蛋白表达纯化系统,获得了高纯度的SPO11-TOP6BL复合体,体外重构了减数分裂DSB的形成,为同源重组的后续研究提供了实验平台和理论基础。
分子细胞卓越中心博士研究生汤辛哲和合作的博士生胡泽涛为该论文的共同第一作者,分子细胞卓越中心童明汉研究员和上海交通大学医学院附属新华医院黄旲教授为该论文的共同通讯作者。
值得一提的是,美国纪念斯隆-凯特琳癌症中心ScottKeeney团队、比利时法语鲁汶大学CorentinClaeysBouuaert团队分别在Nature上发表了背靠背文章“ReconstitutionofSPO11-dependentdouble-strandbreakformation”和“SPO11dimersaresufficienttocatalyseDNAdouble-strandbreaksinvitro”。Nature同期为三篇文章配发了由加利福尼亚大学圣迭戈分校FranciscoMendezDiaz博士和KevinD.Corbett教授共同撰写题为“Enzymeusedinmeiosismakesthecutinvitro”的评述,指出这三项研究代表了减数分裂同源重组领域的"abigbreak",开启了该领域的“aneweraofresearch”。


该研究获国家自然科学基金、科技部、上海市和中国科学院的项目资助。研究工作获中国科学技术大学蔡刚教授、分子细胞卓越中心吴薇研究员、李典范研究员、刘珈泉研究员、丁建平研究员、张少庆研究员以及李党生研究员帮助。分子细胞卓越中心动物实验技术平台、生物信息学平台和中国科学院上海高等研究院国家蛋白质科学研究(上海)设施为该研究提供支持。

童明汉团队合照
