IT之家3月1日消息,微软研究院于2月20日发布博文,宣布推出AI模型BioEmu-1,能够预测蛋白质随时间推移的运动和形状变化,在生物医学、药物发现和结构生物学领域带来新可能。
借助AI探究蛋白质
从形成肌肉纤维到保护我们免受疾病侵害,在几乎所有生物过程中,蛋白质都发挥着至关重要的作用。
科学家近年来利用深度学习,在研究蛋白质结构方面已取得重大进展,能够根据氨基酸序列准确预测蛋白质结构。然而,仅从氨基酸序列预测单一蛋白质结构就像观看电影的单帧画面,只提供了一个高度灵活分子的截图。
微软BioEmu-1
不同于DeepMind的AlphaFold专注于确定静态蛋白质结构,BioEmu-1模拟蛋白质在不同构象之间的动态转换,为理解蛋白质运动、设计有效治疗方案提供了新的工具。
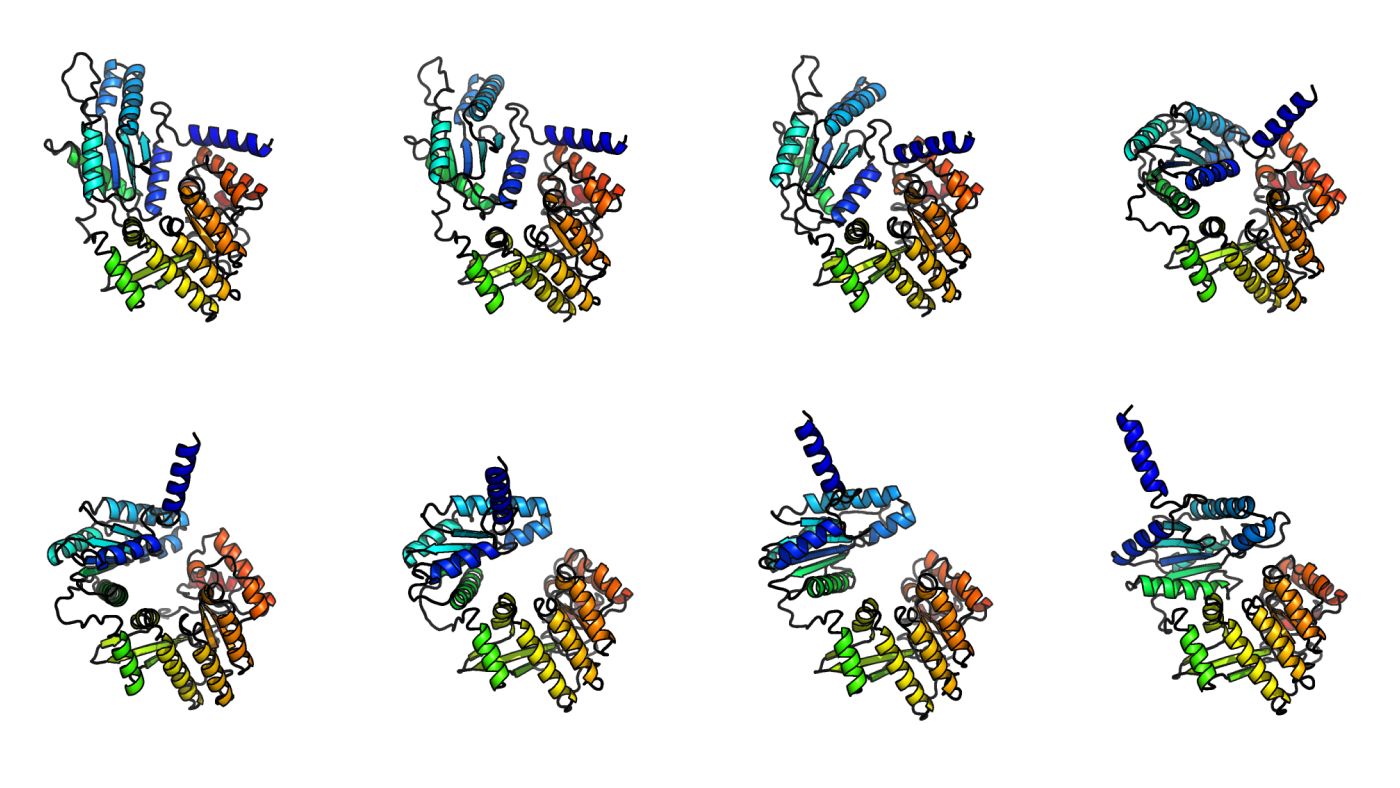
AlphaFold3在结构生物学领域取得了重大进展,改进了蛋白质与DNA、RNA和小分子的相互作用模型,但它无法预测蛋白质随时间的变化。
BioEmu-1弥补了这一不足,它可以生成多个可能的构象,而不仅仅是单一的最佳拟合结构,这在药物开发中尤为重要。
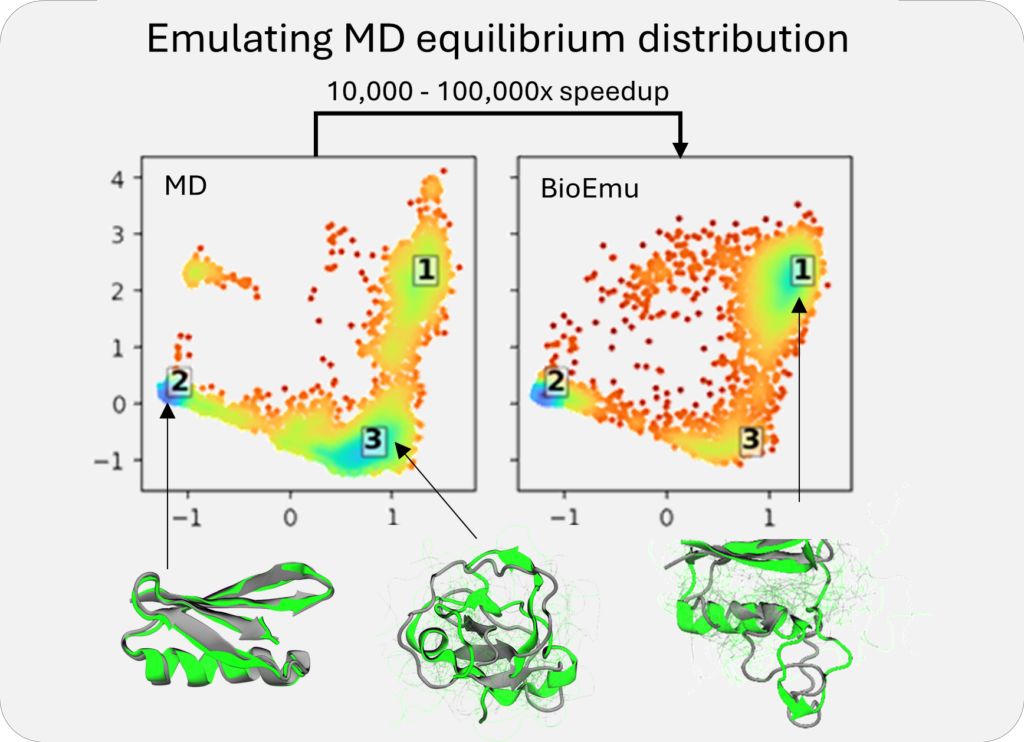
BioEmu-1利用生成式深度学习,从大型数据集中学习模式,然后生成与这些模式一致的新样本,通过结合静态蛋白质结构、分子动力学模拟数据和实验稳定性数据进行训练。
BioEmu-1的核心机制是一个扩散模型,它迭代地生成蛋白质结构并根据学习到的约束条件提高其准确性。BioEmu-1的关键输出是平衡系综的预测和自由能预测。
BioEmu-1使用三种类型的数据集进行训练:(1)AlphaFold数据库(AFDB)结构;(2)广泛的MD模拟数据集;(3)实验性蛋白质折叠稳定性数据集。
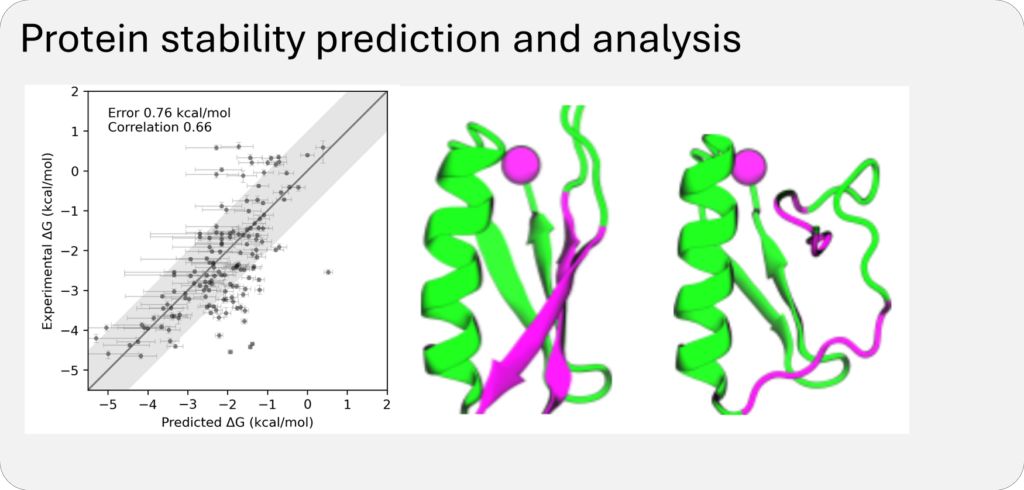
通过这些数据集的训练,BioEmu-1可以识别蛋白质序列映射到多个不同结构,预测合理的结构变化,并学习以正确的概率对折叠和未折叠结构进行采样。
BioEmu-1每小时可生成数千个蛋白质结构样本,相比需要数周时间的传统分子动力学模拟,显著加快了研究速度并降低了计算成本,其预测自由能的误差幅度在1kcal/mol以内,与传统分子动力学模拟相当,但计算成本却显著降低。
IT之家附上参考地址
