转自:生物谷
糖酵解(glycolysis)是细胞从糖中获取能量的主要代谢途径。长久以来,科学家们认为癌细胞主要依赖糖酵解来获得能量,这一现象被称为沃伯格效应(Warburgeffect)。然而,最新的研究表明,癌细胞比我们想象的更加灵活,即使在糖酵解被阻断的情况下,它们也能通过呼吸链获取能量而生存。
近日,一篇发表在国际杂志NatureMetabolism上题为“TargetingaldolaseAinhepatocellularcarcinomaleadstoimbalancedglycolysisandenergystressduetouncontrolledFBPaccumulation”揭示了一个令人兴奋的新发现。德国癌症研究中心的研究团队发现,当阻断一种名为醛缩酶A(aldolaseA)的酶的功能时——这种酶参与了糖酵解过程中的关键步骤——肝癌细胞会经历所谓的“能量压力”,停止分裂活动。研究人员不仅在小鼠肝癌细胞中验证了这一点,还在多种人类癌细胞系中得到了相同的结果。
有趣的是,当研究人员尝试阻断糖酵解早期阶段的一个步骤——即葡萄糖-6-磷酸异构酶的作用时,这对癌细胞的生长似乎并没有影响。Schulze博士解释道,“虽然糖酵解路径本身不是必须的,但糖酵解酶醛缩酶对肝癌细胞来说却是不可或缺的。”这听起来可能有些矛盾,因为通常情况下,阻止这些酶应该会抑制糖类的降解。
然而,深入探究糖酵解的生化步骤后,科学家们发现这条代谢路径可以分为两个部分:首先,细胞需要投入能量生成高能中间产物果糖-1,6-二磷酸(fructosebisphosphate)。醛缩酶A在这个过程中扮演着独特且易受影响的角色,无论肿瘤的基因型或环境条件如何。
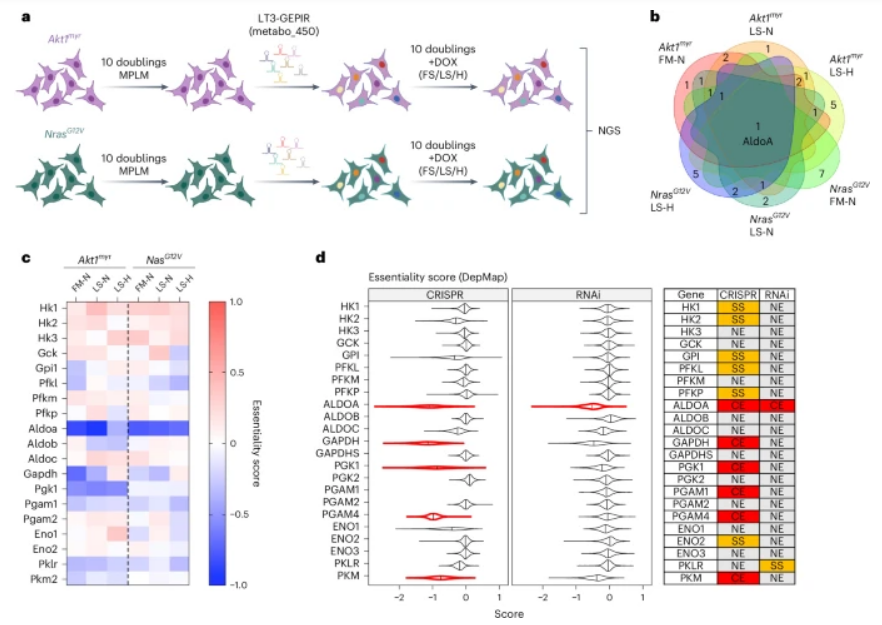
如果醛缩酶A被关闭,果糖-1,6-二磷酸就会在细胞内堆积,其中储存的能量无法被利用。这意味着细胞不能继续进行正常的能量获取步骤,反而使糖酵解从一个产生能量的过程变成了消耗能量的过程。更糟糕的是,缺乏能量会进一步刺激果糖-1,6-二磷酸的生成,形成恶性循环,最终导致能量消耗超过能量生产。对于肝癌细胞而言,这会导致严重的能量短缺、细胞周期停滞以及肿瘤生长受到抑制。
Snaebjornsson教授补充说:“通过关闭醛缩酶A的功能,我们不仅能阻断糖酵解产生的能量,还能阻止细胞转向其他代谢途径,因为能量被困在果糖-1,6-二磷酸中。”因此,靶向抑制醛缩酶A或许成为了一种对抗癌细胞的新策略。尽管目前可用的醛缩酶A抑制剂仅限于实验用途,尚未作为药物批准使用,但研究人员正在测试其作为癌症治疗的潜力。
值得注意的是,即使只是轻微降低醛缩酶A的活性也足以让癌细胞陷入“能量陷阱”。正常细胞由于摄入的葡萄糖较少,产生的富含能量的果糖-1,6-二磷酸也相对较少,因此能够承受这种情况。换句话说,沃伯格效应成为了癌细胞的一个致命弱点,使其对醛缩酶A的阻滞变得敏感。深入理解肿瘤代谢有望为开发创新性癌症治疗方法铺平道路,特别是那些能够针对癌细胞代谢弱点而不损害健康细胞的疗法。
总之,这项研究表明,通过靶向醛缩酶A以诱导糖酵解失衡,可能是克服癌细胞内在代谢灵活性的独特机会。
参考文献:
Snaebjornsson,M.T.,Poeller,P.,Komkova,D.etal.TargetingaldolaseAinhepatocellularcarcinomaleadstoimbalancedglycolysisandenergystressduetouncontrolledFBPaccumulation.NatMetab(2025).doi:10.1038/s42255-024-01201-w
(转自:生物谷)
