转自:生物谷
如果您曾留意生活中的细节,或许会发现这样的场景:在小区的长椅上,一位老人的手不由自主地微微颤抖,起身行走时动作迟缓、步态蹒跚。
这些看似奇怪的表现,很可能是帕金森病在作祟。帕金森病,这个在老年人群体中并不罕见的疾病,正悄无声息地影响着无数人的生活。据统计,全球约有1000万帕金森病患者,我国患者人数约占一半,它不仅给患者带来身体上的痛苦,还严重降低了他们的生活质量,让原本简单的日常活动,如穿衣、吃饭、行走,都变得困难重重。多年来,科学家们一直在不懈努力,试图揭开帕金森病的神秘面纱,找到更有效的治疗方法。
最近,发表在NPJParkinsonsDis上的一项研究Novelco-culturemodelofTcellsandmidbrainorganoidsforinvestigatingneurodegenerationinParkinson'sdisease给帕金森病的研究带来了新的曙光。

一直以来,人们都认为中枢神经系统是免疫豁免的,与免疫系统相对隔绝。但随着医学研究的不断深入,这个传统观念被打破了。科学家们发现,在中枢神经系统的健康和患病状态下,免疫细胞都在其中发挥着作用。在帕金森病患者体内,血脑屏障的完整性遭到破坏,就像一道原本坚固的城墙出现了缺口,使得外周免疫细胞,尤其是T细胞,能够侵入大脑。大量研究表明,T细胞的浸润与帕金森病的发生和病情恶化密切相关。然而,T细胞与大脑细胞之间具体是如何“交流”的,它们相互作用的机制是什么,这些问题一直困扰着科研人员。
为了攻克这一难题,研究团队另辟蹊径,开发了一种全新的模型。他们将人类中脑类器官(hMO)和外周血T细胞结合起来,构建了一种三维共培养模型。
研究人员首先聚焦于hMO的特性研究。他们从健康供体的成纤维细胞入手,通过一系列复杂的技术操作,将其转化为诱导多能干细胞(hiPSC),随后诱导这些干细胞分化形成hMO。在这个过程中,hMO不断发育成熟,细胞类型从以SOX2+神经祖细胞为主,逐渐转变为富含成熟的MAP2+神经元。同时,hMO还稳定表达TH、FOXA2等中脑特异性标记物,这为后续研究提供了极为可靠的细胞模型。
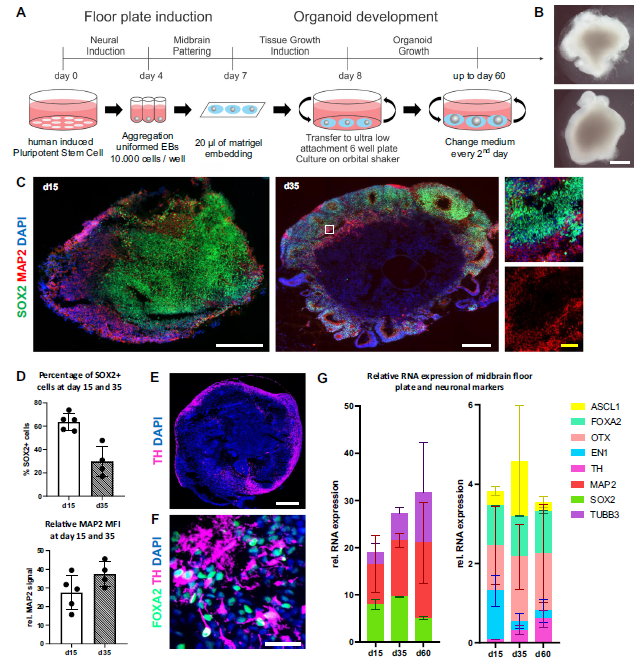
确定了hMO的特性后,研究人员开始优化T细胞与hMO的共培养条件。经过多次试验和对比,他们发现白细胞介素2(IL-2)对于维持T细胞的活力和激活状态起着关键作用,而hMOM培养基则能为hMO的存活提供理想环境。最终,添加IL-2的hMOM培养基成为了最适宜的共培养条件。
在优化后的共培养体系中,研究人员取得了一系列重要发现。激活后的T细胞展现出更强的“侵入”能力,能够顺利进入hMO组织。进一步检测发现,浸润的T细胞高表达LFA-1和VLA-4整合素,而hMO组织中恰好存在它们的配体ICAM-1和VCAM-1,这意味着这些分子很可能在T细胞的浸润过程中扮演着重要角色。
T细胞的浸润给hMO带来了明显变化。与未共培养的hMO相比,共培养后的hMO出现了细胞死亡增加和神经元丢失的情况。深入分析发现,浸润的T细胞会释放颗粒酶B、CD107a等细胞毒性蛋白,同时还会分泌IFN-γ、TNF-α和IL-17等促炎细胞因子,这些物质共同作用,对神经元造成了损伤。
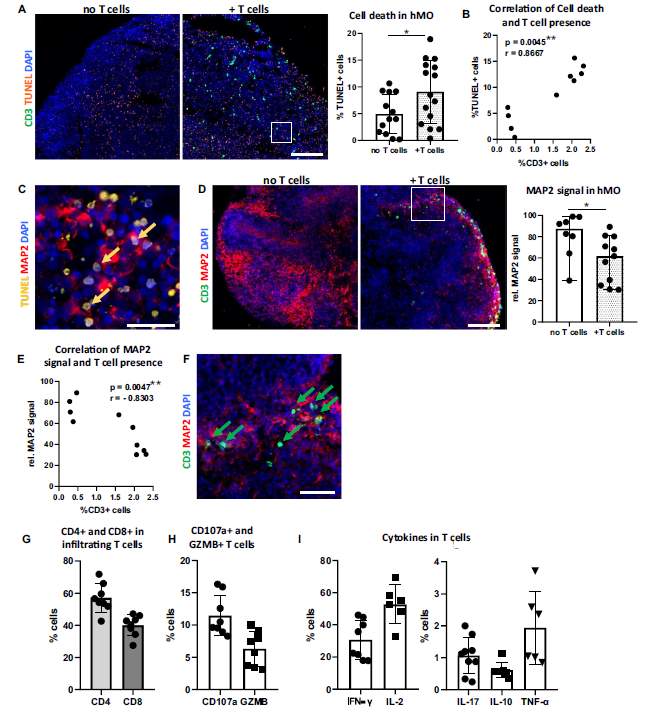
此外,研究人员还发现hMO对T细胞的敏感性存在差异。从年龄方面来看,60天的hMO比30天的hMO更容易受到T细胞的浸润,这一结果提示我们,在研究帕金森病这类与年龄相关的神经退行性疾病时,年龄因素至关重要。从区域特异性来讲,与人类大脑皮层类器官(hCO)相比,hMO对T细胞浸润更为敏感。T细胞浸润hCO后,细胞死亡和神经元丢失的现象并不明显,这表明不同脑区组织对T细胞的反应存在差异。

总体而言,这项研究所构建的三维共培养模型为深入研究帕金森病中T细胞与大脑细胞的相互作用提供了强大的工具。借助这个模型,我们对T细胞影响中脑组织的机制有了更深入的理解,也认识到这种影响在年龄和脑区方面存在差异。这不仅推动了帕金森病发病机制的研究进程,更为未来帕金森病治疗方法的开发提供了新的方向和思路,有望在未来为众多帕金森病患者带来新的希望和更好的生活。
参考文献:
GerasimovaE,BeenenAC,KachkinD,etal.Novelco-culturemodelofTcellsandmidbrainorganoidsforinvestigatingneurodegenerationinParkinson'sdisease.NPJParkinsonsDis.2025;11(1):36.Published2025Feb28.doi:10.1038/s41531-025-00882-8
(转自:生物谷)
