移植器官短缺是全世界面临的医学难题。近年来,在基因编辑等新技术推动下,以猪为供体的异种器官移植不断取得进展。首例基因改造猪肝脏移植到人类受体的研究进展有了新动态。
伦敦时间3月26日(北京时间3月27日凌晨零点),中国研究团队在英国《自然》杂志在线发表论文,报告世界首例将基因编辑猪的肝脏移植到脑死亡人体内的成功案例。《自然》网站相关报道表示这是“将动物器官移植给人的一个里程碑”。

论文截图。受访者供图。
中国科学院院士窦科峰带领西京医院等机构的研究团队,以一只经过6处基因编辑的猪为供体,将猪的肝脏移植到一名已脑死亡但身体基本机能仍被维持的人的体内,人类受体自身的肝脏被保留,以此模拟临床肝衰竭患者的替代支持治疗过程。
3月25日晚,在《自然》(Nature)杂志全球新闻发布会上,该研究团队介绍了基因编辑供体猪的情况。据介绍,这是已知的全球首个将基因编辑猪的肝脏移植给脑死亡人类受体的成功案例,论文发表标志着这项去年3月完成的研究成果得到国际学术界承认。《自然》网站相关报道表示这是“将动物器官移植给人的一个里程碑”。
“移植的猪肝脏在人体内正常发挥生理功能,短期内没有出现跨物种感染。”窦科峰表示,在移植后的10天观察期内,未发现猪内源性逆转录病毒在人体传播的情况,表明供体猪的“六基因编辑策略+受体特异性免疫抑制”方案组合,在控制异种肝移植超急性排斥和急性排斥方面安全有效。
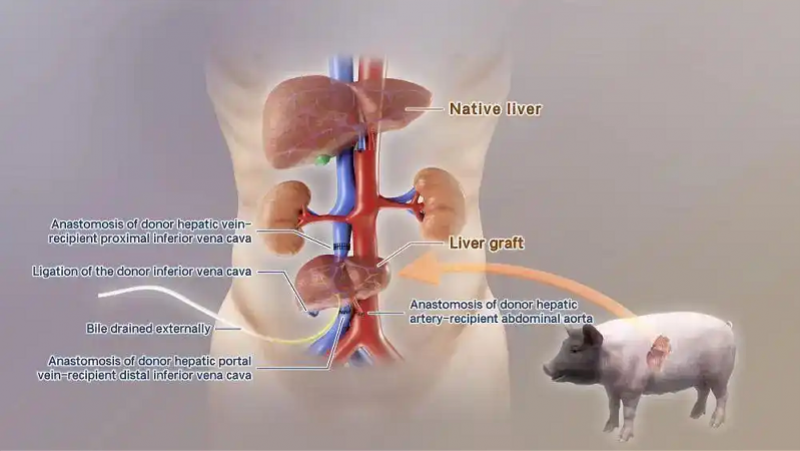
本次研究中基因编辑猪肝脏移植示意图。(研究团队供图)
据介绍,这项研究的手术方案先后通过相关的学术委员会、伦理委员会等论证,严格按照国家有关规定逐项进行。人类受体为一例重型闭合性颅脑损伤患者,经全力抢救仍脑死亡,患者家属同意无偿参与异种肝移植科学研究,为医学进步作出贡献。移植研究在10天后因家属意愿终止。
这是全球范围内第一次将基因编辑猪肝脏移植入人体,该项研究的成功是异种器官移植领域的重大突破,是异种肝移植迈向临床应用的关键一步,也是团队深耕异种移植研究12年艰辛付出的成果。
南都记者获悉,本次器官供体猪由位于四川省内江市的中科奥格DPF医用供体猪培育中心提供。中科奥格董事长潘登科向南都记者介绍,全球范围内,肝脏移植是终末期肝病患者的重要希望,但供体短缺问题一直严重制约着这一治疗手段的广泛应用。猪器官因其生理功能、大小与人类较为匹配,成为极具潜力的供体来源。研究成功将基因编辑猪肝脏移植到脑死亡患者体内,为解决肝脏移植供体短缺带来新希望。
据了解,中科奥格提供的基因编辑猪,在此次研究中发挥了关键作用。这些猪过6处基因编辑,敲除了介导超急性排斥反应的关键基因,如GGTA1、β4GalNT2和Neu5Gc,同时插入了有助于异种移植相容性的人源基因(CD46、CD55、TBM),大大降低了免疫排斥风险,为移植手术的成功奠定了坚实基础。
除中国外,美国已开展了多例人体移植猪器官手术,美监管机构还为移植猪肾脏进入临床试验“开绿灯”。那么,猪何以能为人类“跨物种救命”?推进异种器官移植还面临哪些难题?
“跨物种救命”源于自身优点
不同物种间的器官移植被称为异种器官移植。目前全球捐献的人体器官远远不能满足需求,异种器官移植被认为是解决移植器官短缺最可能的方向之一。医学界此前曾尝试以黑猩猩和狒狒等灵长类动物作为肾脏、肝脏等移植器官的供体,但效果都不理想。
猪的器官组织结构、生理功能等与人体器官相近,并且与人类亲缘关系较远,传播人畜共患疾病的风险较小;猪的饲养成本低、种类丰富、繁殖能力出色。这些优点吸引了科学家的目光,猪被视为异种器官移植的理想供体候选者。但是,将猪器官移植到人体内还有两大风险:猪的基因组携带内源性逆转录病毒,移植到人体后可能有毒性;猪器官可能引发人类免疫系统的排异反应。
基因编辑技术和免疫学的发展为人体移植猪器官扫除了障碍。科学家可以通过基因编辑技术去除或关闭猪身上有风险的基因,并插入一些人类基因,从而提高接受移植者长期存活的可能性。中美等国研究人员2017年报告说,他们用基因编辑技术“敲除”了猪基因组中所有内源性逆转录病毒。巴西圣保罗大学生物科学研究所研究人员2019年报告说,科学家已确认猪体内能引发人体排异反应的3个基因,用基因编辑技术关闭这些基因就可能消除排异反应。
在这些进展的基础上,医学界逐步探索开展猪器官移植手术,其中美国进展迅速。2022年1月,美国马里兰大学专家进行了全球首例将基因编辑猪的心脏移植到人体的手术,患者术后存活了约2个月。2023年9月,该机构完成第二例基因编辑猪心脏移植手术,患者约40天后死亡。
肾脏移植也是探索的热点领域。2023年7月,美国纽约大学兰贡医疗中心将基因编辑猪的肾脏移植到一名已脑死亡但维持生理机能的受试者体内,猪肾脏能正常工作。2024年3月,美国马萨诸塞综合医院将基因编辑猪的肾脏移植入一名美国男性终末期肾病患者体内,为全球首例。这名时年62岁的患者在手术后近2个月死亡,但医院发表声明说,没有迹象表明他的死亡是由肾脏移植造成。
希望与挑战并存
正如上述案例所示,患者术后存活率低还是制约异种器官移植的一大挑战。不过,每一次失败都是迈向成功的基础。
2024年12月,美国纽约大学兰贡医疗中心宣布,成功为一名53岁女性肾病患者进行了基因编辑猪肾脏移植手术。2025年2月25日,兰贡医疗中心发布公报说,这名女性接受移植手术满3个月后已返回家中,后续还要定期复查,她已成为移植基因编辑猪肾脏后存活最久的患者。
上述移植手术都是在美国食品和药物管理局“同情使用”规则下进行的。该规则适用于患有严重或危及生命疾病的患者,在不能通过已上市药品或入组临床试验的方式获得有效治疗时,可使用未经上市审批的研究性药物或治疗手段。
2025年2月初,美药管局正式批准两家生物公司开展猪肾脏移植临床试验,标志着这一领域从“实验性尝试”走向“临床验证”的新阶段。美国媒体报道说,“一旦成功,这些试验可能会彻底改变器官移植现状,帮助解决供体肾脏严重短缺的问题”。
虽然异种器官移植在解决移植器官短缺方面被寄予厚望,但目前仍面临重重挑战,如排异反应可能难以完全避免、跨物种移植存在生物安全隐患等等。此外,医学界对人体移植动物器官后的长期健康影响、接受移植者生活质量、移植器官功能维持状况等领域还缺少研究。同时,异种器官移植还涉及人类学、社会学、伦理学等多个领域的问题,可能会对社会伦理造成冲击。
鉴于此,医学界呼吁,推进异种器官移植,需要国际社会、各国政府、科研及医学界等多方合力、审慎推进,要科学评价研究进展,清醒认知相关风险,并加强立法监管。
整合:林诗妍
部分内容来源新华社
