转自:生物谷
在谈癌色变的今天,脑肿瘤中的胶质母细胞瘤(GBM)堪称“恶魔”般的存在。它恶性程度极高,对传统治疗手段有着很强的抵抗性。即便接受了手术、放疗和化疗,患者的中位生存期通常也只有12-14个月,令人痛心。这主要是因为GBM的肿瘤细胞具有高度异质性,而且血脑屏障像一道坚固的防线,阻挡了化疗药物进入肿瘤,导致耐药和频繁复发。所以,寻找更有效的治疗方法迫在眉睫。
近期,发表于MolPharm的一项研究DevelopmentandInVitroCharacterizationofMilk-DerivedExtracellularVesicle-MithramycinFormulationsforPotentialGliomaTherapy带来了新的曙光。
研究人员探索了用牛奶来源的细胞外囊泡(mEVs)搭载光神霉素(Mit-A),用于治疗胶质母细胞瘤的可能性。光神霉素是一种有潜力的抗肿瘤药物,能通过与富含GC序列的DNA结合,干扰SP家族转录因子与基因启动子的结合,从而抑制肿瘤生长,在包括胶质母细胞瘤在内的多种癌症治疗中展现出希望。然而,其严重的全身毒性和肝毒性,大大限制了它在临床上的应用。

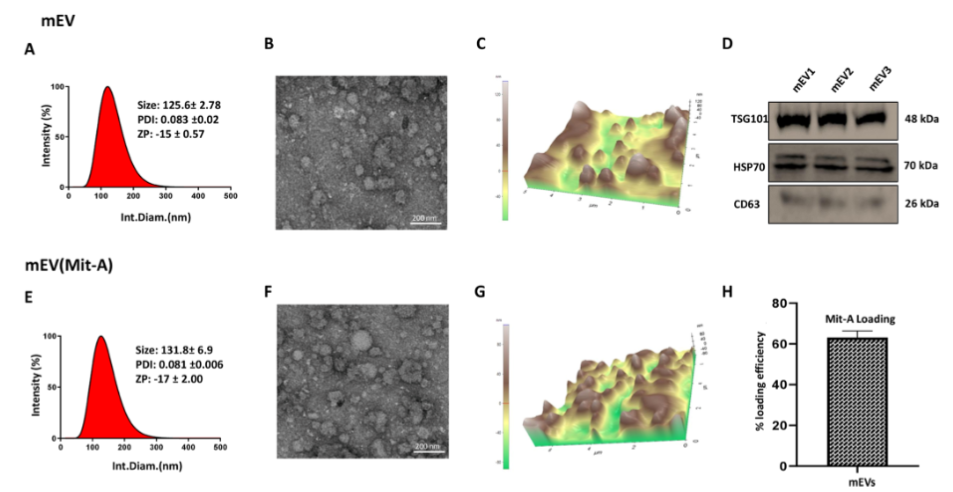
研究人员首先从水牛乳中提取了mEVs,并对其进行了全面的表征分析。通过动态光散射(DLS)、透射电子显微镜(TEM)和原子力显微镜(AFM)等技术检测发现,分离出的mEVs平均直径为125.6±2.78nm,多分散指数(PDI)为0.083±0.02,ζ电位为-15±0.57mV,且具有典型的细胞外囊泡标记物TSG101、HSP70和CD63,这证实了其纯度和完整性。
随后,研究人员利用冻融法将光神霉素封装到mEVs中,成功制备出mEV(Mit-A)制剂,其封装效率达到58%。封装后,mEV(Mit-A)的直径略微增加到131.8±6.9nm,PDI为0.081±0.006,ζ电位降低至-17±2.0mV。
在一系列实验中,mEV(Mit-A)制剂展现出了令人期待的性能。体外跨上皮转运实验表明,相较于游离的光神霉素,mEV(Mit-A)能更有效地转运光神霉素穿过Caco-2细胞的上皮屏障,这对口服给药系统至关重要。在模拟唾液、胃液和肠液的环境中,mEV(Mit-A)制剂也表现出良好的稳定性,其粒径和PDI在不同消化液中没有显著变化。
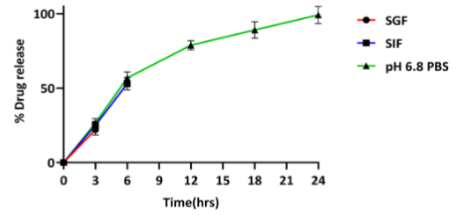
药物释放实验结果显示,在模拟不同生理pH条件下(pH3.0、7.0和6.8),mEV(Mit-A)制剂中的光神霉素呈现出时间依赖性释放。在3小时内,光神霉素的释放量在不同pH环境下相对稳定,而在24小时时,在pH6.8的磷酸盐缓冲液(PBS)中释放量达到最大。与之对比,游离的光神霉素在3小时内就几乎完全释放。
生物相容性实验使用小鼠成纤维细胞系(L929)进行,结果表明,mEV(Mit-A)制剂的生物相容性明显优于游离的光神霉素。游离光神霉素在浓度超过150nM时表现出显著的细胞毒性,而mEV(Mit-A)制剂在浓度达到250nM时仍具有较好的生物相容性。在评估肝毒性的实验中,以HepG2细胞为模型,研究发现mEV(Mit-A)制剂能够有效减轻光神霉素诱导的肝毒性,因为它不会显著诱导BTG2基因表达,而游离光神霉素会使BTG2基因表达明显增加。
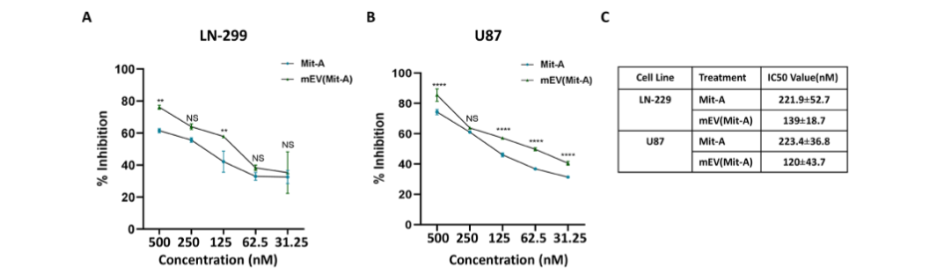
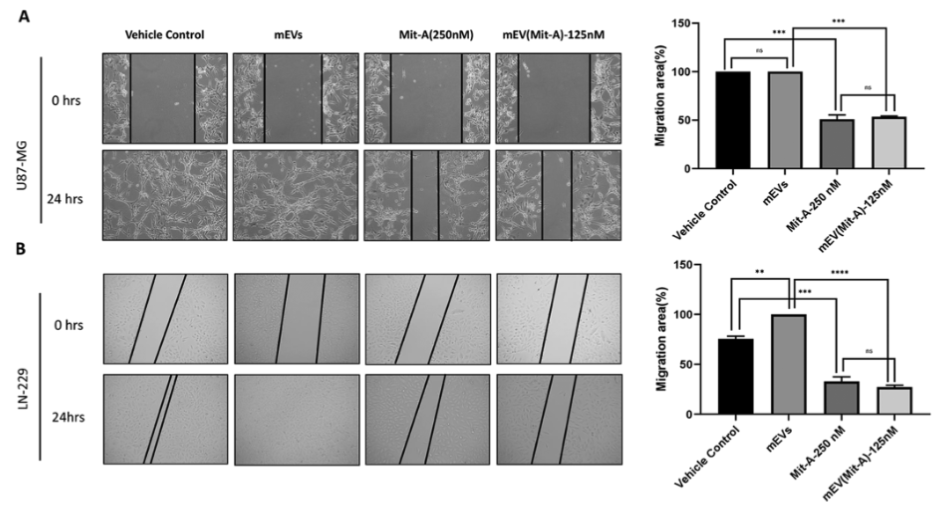
在对U87和LN-229胶质母细胞瘤细胞系的研究中,mEV(Mit-A)制剂展现出强大的抗肿瘤活性。它能显著抑制细胞增殖,其半最大抑制浓度(IC50)比游离光神霉素低约2倍。划痕实验证实,mEV(Mit-A)制剂能够显著抑制细胞迁移。进一步研究发现,mEV(Mit-A)制剂可通过PARP1介导的线粒体途径诱导细胞凋亡,同时还能抑制SP1通路及其下游靶基因MYC、VEGF的表达,并上调P21的表达,从而抑制肿瘤生长和进展。
综上所述,这项研究表明mEV(Mit-A)制剂在胶质母细胞瘤治疗方面展现出巨大潜力。它不仅提高了光神霉素的生物利用度和治疗效果,还显著改善了其生物相容性和安全性。mEV(Mit-A)制剂有望成为一种创新的口服药物递送系统,为胶质母细胞瘤患者带来新的希望。期待未来能有更多深入研究,推动这一成果从实验室走向临床,真正造福患者。
参考文献:
PatnamS,SinghAD,AliMS,ThakurBK,RenganAK,MandaSV.DevelopmentandInVitroCharacterizationofMilk-DerivedExtracellularVesicle-MithramycinFormulationsforPotentialGliomaTherapy.MolPharm.PublishedonlineMarch26,2025.doi:10.1021/acs.molpharmaceut.4c01189
(转自:生物谷)
