上海2025年6月4日--5月30日-6月3日在美国芝加哥举办的2025美国临床肿瘤学会年会(ASCO)上,9MW2821与特瑞普利单抗联合用于治疗局部晚期或转移性尿路上皮癌(la/mUc)患者的Ib/II期临床研究结果由北京大学肿瘤医院泌尿肿瘤内科主任医师盛锡楠教授代表研究团队进行了报告。9MW2821联合特瑞普利单抗在尿路上皮癌展现了令人鼓舞的疗效及良好的安全性。
口头报告
研究背景:
尿路上皮癌(UC)是世界范围内常见的恶性肿瘤。2024年发布的全球癌症统计报告中显示,膀胱癌是全球第九大常见诊断的癌症,每年有新发病例约61.4万,死亡病例约22.0万。男性疾病负担和发病率显著高于女性,膀胱癌是男性第六大常见癌症,是男性癌症死亡第九大原因[1]。
9MW2821(BulumtatugFuvedotin,BFv)是新一代靶向Nectin-4的抗体偶联药物,早期研究显示9MW2821在既往接受过含铂化疗和免疫检查点抑制剂的局部晚期或转移性尿路上皮癌人群中展现了具有潜力的疗效[2]。单药末线的III期关键临床正在进行中(NCT06196736,CTR20234024)。
特瑞普利单抗(Toripalimab)是一种新型人源化重组抗PD-1单抗,已先后在中美等多国获批上市。
本次ASCO会议首次详细汇报了9MW2821联合特瑞普利单抗在局部晚期或转移性尿路上皮癌患者中疗效和安全性。
研究方法:
本研究是一项开放、多中心的Ib/II期临床试验,筛选合格的受试者将接受9MW2821联合特瑞普利单抗治疗。特瑞普利单抗采用固定给药剂量240mg,在剂量递增阶段9MW2821从1.0mg/kg递增至1.25mg/kg,在队列扩展阶段将分别在1.0mg/kg和1.25mg/kg剂量组进行扩展。每21天1个周期,9MW2821每周期D1和D8各给药一次,特瑞普利单抗每周期D1给药一次,直至发生疾病进展或不可耐受的毒性。

研究结果:
截至2025年4月30日,本研究共入组52例局部晚期或转移性尿路上皮癌(la/mUC)受试者。40例可肿评的晚期UC一线受试者中,中位年龄67岁,70%为男性,72.5%ECOG评分为1分,肿瘤原发部位为上尿路的占比55%,肝转移占比15%。生物标志物表达方面,82.5%为Nectin-4表达阳性,20%为PD-L1表达阳性。
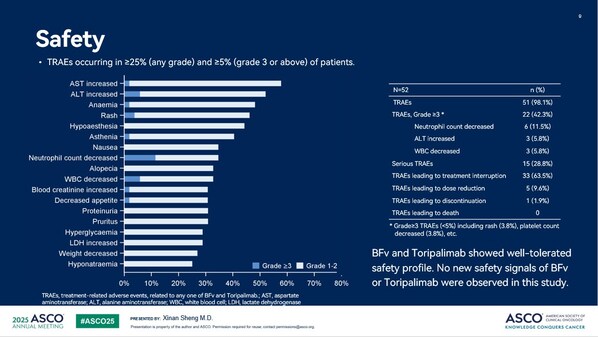
研究结果显示,客观缓解率(ORR)为87.5%(95%CI:73.2,95.8),经确认的ORR为80%,CR率为12.5%。疾病控制率(DCR)为92.5%(95%CI:79.6,98.4)。最佳靶病灶大小变化与基线相比,97.5%的受试者肿瘤病灶缩小,57.5%的受试者肿瘤缩小超过50%。
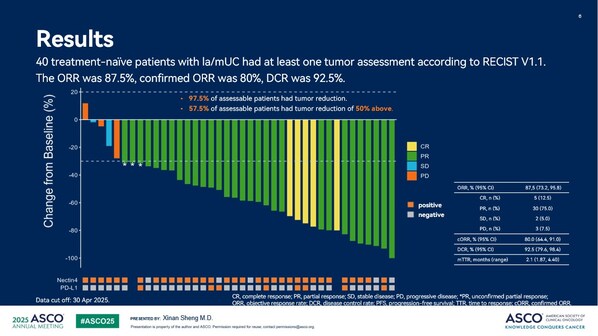
ORR亚组分析显示,在选定的亚组中,ORR获益与总体人群保持一致。无论年龄、肿瘤原发部位、是否基线存在肝转移、以及肿瘤生物标志物Nectin-4和PD-L1的表达状态,所有亚组均可从9MW2821联合特瑞普利单抗的治疗中获益。年龄超过65岁、肿瘤原发部位为下尿路、肝转移、Nectin-4表达阴性以及PD-L1表达阳性的受试者ORR分别为100%(24/24)、94.44%(17/18)、83.33%(5/6)、100%(7/7)、100%(8/8)。
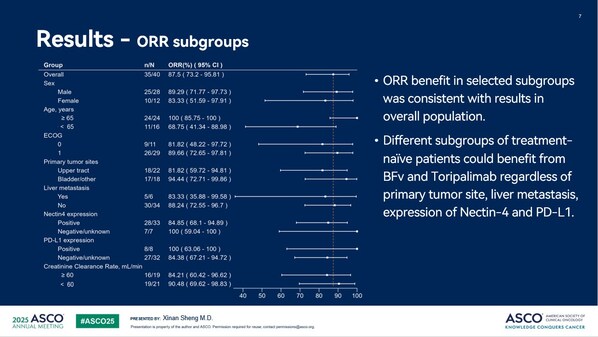
截至2025年4月30日,45%(18/40)受试者发生疾病进展或死亡,中位无进展生存期(mPFS)为12.5个月(95%CI:6.47-NA),中位缓解持续时间(mDoR)尚未达到。中位随访时间为10.8个月,mPFS和mDoR尚未成熟。
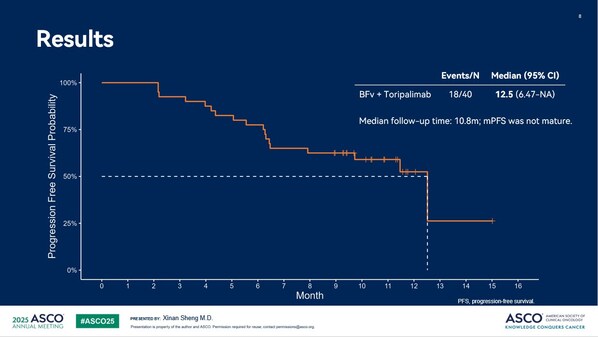
安全性方面,治疗相关不良事件(TRAE)发生率为98.1%,绝大多数TRAE为1-2级;3级及以上TRAE发生率为42.3%,≥3级的TRAE主要表现为中性粒细胞计数降低(11.5%)、ALT升高(5.8%)、白细胞计数降低(5.8%)等;治疗相关严重不良事件的发生率为28.8%,未发生导致死亡的TRAE。联合治疗过程中,受试者整体耐受性良好,未观察到新的安全性信号。
结论:
9MW2821联合特瑞普利单抗治疗局部晚期或转移性尿路上皮癌展现出了令人鼓舞的疗效及良好的安全性特征。值得注意的是,本研究中高龄、肝转移以及生物标志物Nectin-4表达为阴性的受试者也均取得了相当可观的疗效缓解,预示着相较于传统含铂化疗,9MW2821联合特瑞普利单抗将为那些不能耐受含铂化疗或潜在化疗预后差的晚期尿路上皮癌患者提供新的治疗选择,有望成为真正意义上的、可覆盖全部晚期尿路上皮癌人群的新疗法。9MW2821联合特瑞普利单抗对比含铂化疗治疗一线晚期尿路上皮癌的III期关键注册临床研究正在进行中(NCT06592326,CTR20242828)。
关于9MW2821
9MW2821是由迈威生物自主研发的靶向Nectin-4ADC创新药,通过具有自主知识产权的偶联技术连接子及优化的ADC偶联工艺,实现抗体的定点修饰。该品种是国内同靶点药物中首个开展临床试验的品种,亦是全球同靶点药物中首个在宫颈癌、食管癌以及乳腺癌适应症披露临床有效性数据的品种。目前已开展三项III期关键性注册临床。尿路上皮癌单药、联合特瑞普利单抗治疗均被CDE纳入突破性治疗品种名单。并已被FDA授予3项快速通道认定(FTD)和1项孤儿药资格认定(ODD)。
[1]BrayF,etal.Globalcancerstatistics2022:GLOBOCANestimatesofincidenceandmortalityworldwidefor36cancersin185countries[J].CACancerJClin,2024;
[2]Zhangetal.ASCO2024.
关于迈威生物
迈威生物(688062.SH)是一家全产业链布局的创新型生物制药公司,始终秉承"让创新从梦想变成现实"的愿景,践行"探索生命,惠及健康"的使命,通过源头创新,为患者提供疗效更好、可及性更强的生物创新药,满足全球未被满足的临床需求。2017年成立以来,迈威生物构建了以抗体药物靶点发现与分子发现为起点,覆盖成药性研究、临床前研究、临床研究和生产转化等药品研发全周期的创新体系,实现集研发、生产、营销于一体的全产业链布局。我们专注于肿瘤和年龄相关疾病,涉及肿瘤、自身免疫、骨疾病、眼科、血液、感染等治疗领域,凭借国际领先的特色技术平台和研发创新能力,建立了丰富且具有竞争力的管线。现有16个品种处于不同阶段,包括12个创新品种和4个生物类似药,其中4个品种上市,1个品种已提交上市许可申请前沟通(pre-NDA)会议申请,2个品种处于III期关键注册临床阶段。并独立承担1项国家"重大新药创制"重大科技专项、2项国家重点研发计划和多个省市级科技创新项目。迈威生物以创新为本,注重产业转化,符合中国NMPA、美国FDA、欧盟EMAGMP标准的抗体和重组蛋白药物产业化基地已在江苏泰州投入使用,并已通过欧盟QP审计,位于上海金山和江苏泰州的大规模商业化生产基地正在建设中。欲了解更多信息,请访问:。
前瞻性声明
本新闻稿所发布的信息中可能会包含某些前瞻性表述。这些表述本质上具有相当风险和不确定性。在使用"预期"、"相信"、"预测"、"期望"、"打算"及其他类似词语进行表述时,凡与本公司有关的,目的均是要指明其属前瞻性表述。本公司并无义务不断地更新这些预测性陈述。
这些前瞻性表述乃基于本公司管理层在做出表述时对未来事务的现有看法、假设、期望、估计、预测和理解。这些表述并非对未来发展的保证,会受到风险、不确性及其他因素的影响,有些乃超出本公司的控制范围,难以预计。因此,受我们的业务、竞争环境、政治、经济、法律和社会情况的未来变化及发展的影响,实际结果可能会与前瞻性表述所含资料有较大差别。
本公司、本公司董事及雇员代理概不承担(a)更正或更新本网站所载前瞻性表述的任何义务;及(b)若因任何前瞻性表述不能实现或变成不正确而引致的任何责任。