转自:生物谷
便秘是困扰全球数亿人的常见胃肠道问题,全球患病率达10.1%–15.3%,青少年和老年人更是高发群体,分别为0.7%–29.6%和高达30%。这种以排便周期延长、粪便干硬、排便困难为特征的病症,不仅严重影响生活质量,更带来沉重的长期医疗负担。目前临床常用的泻药存在副作用和药物依赖风险,因此寻找安全有效的替代方案成为当务之急。
近期,发表在FoodResInt上的一项研究2'-FucosyllactosesynbioticswithBifidobacteriumbifidumtoimproveintestinaltranscriptionalfunctionandgutmicrobiotainconstipatedmice探索了2'-岩藻糖基乳糖(2'-FL)与双歧杆菌(B.bifidum)组成的合生素在改善便秘中的作用,为这一问题提供了新的解决思路。

研究通过洛哌丁胺诱导构建便秘小鼠模型,评估2'-FL联合B.bifidum的干预效果。结果显示,该合生素能显著改善便秘表型,提高粪便含水量和小肠推进率,缩短全肠道转运时间,且效果优于单独使用2'-FL或B.bifidum。其机制与调节肠道水吸收相关,可下调水通道蛋白AQP4的表达以减少肠道过度吸水;同时影响胃肠调节肽分泌,促进胃泌素(GAS)和P物质(SP)等兴奋性肽的分泌,抑制血管活性肠肽(VIP)等抑制性肽的释放,从而优化排便参数。
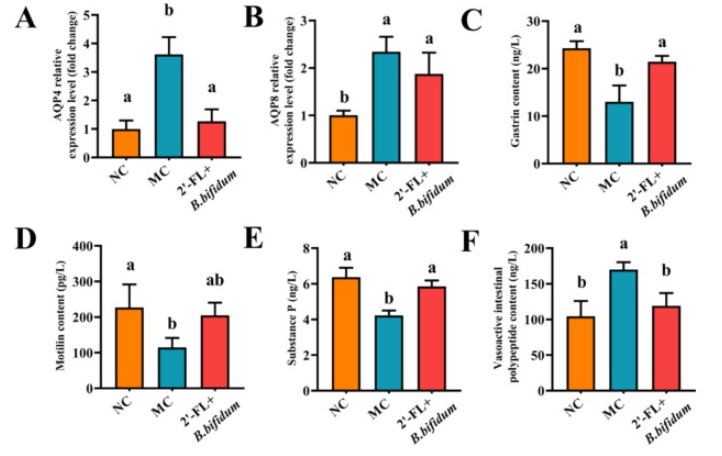
图1:2'-岩藻糖基乳糖联合双歧杆菌对小鼠水通道蛋白和胃肠调节肽的影响
在肠道炎症与屏障功能方面,2'-FL+B.bifidum可显著降低促炎因子TNF-α、IL-1β和IL-6水平,升高抗炎因子IL-10水平,减轻肠道炎症反应。同时,该合生素上调紧密连接蛋白ZO-1、Claudin-1和Occludin的表达,降低血清中D-乳酸、肠毒素和二胺氧化酶等水平,有效修复肠道屏障损伤,维持肠道机械屏障的完整性。
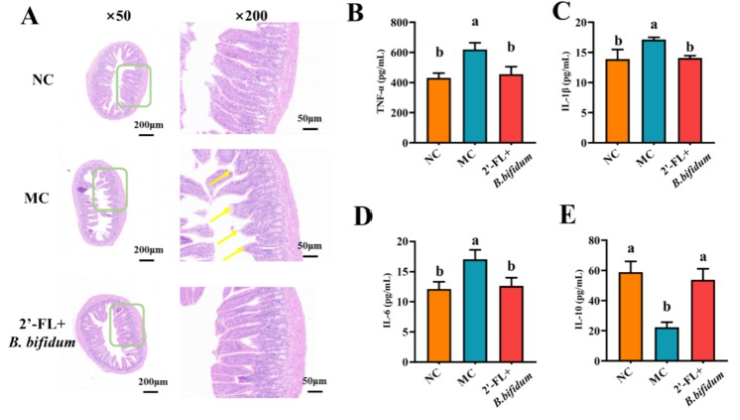
图2:2'-岩藻糖基乳糖联合双歧杆菌对小鼠肠道组织及炎症反应的影响
转录组学分析揭示,2'-FL+B.bifidum可调控肠道细胞的基因表达谱,涉及932个上调基因和540个下调基因。这些差异基因主要富集于免疫系统过程、信号通路、ABC转运蛋白、糖酵解/糖异生及丁酸代谢等通路,提示其可能通过增强肠道物质转运、能量代谢及免疫调节功能改善便秘。其中,丁酸代谢通路的激活与肠道内丁酸含量升高一致,而丁酸作为肠道上皮细胞的主要能量来源,可促进肠道功能恢复。
肠道菌群分析显示,2'-FL+B.bifidum能显著重塑便秘小鼠的肠道菌群结构。干预后,Akkermansia、双歧杆菌(Bifidobacterium)和Parabacteroides等有益菌丰度显著增加,而Lachnoclostridium、葡萄球菌(Staphylococcus)等潜在有害菌丰度降低。LEfSe分析进一步证实,Akkermansia、双歧杆菌等是合生素干预后的特征性优势菌群,它们可能通过代谢2'-FL产生短链脂肪酸、增强肠道黏液屏障、促进肠道蠕动等方式协同改善便秘。此外,这些菌群与免疫调节、能量代谢相关基因的表达存在相关性,提示肠道菌群与宿主转录组的协同调控可能是合生素发挥作用的重要机制。
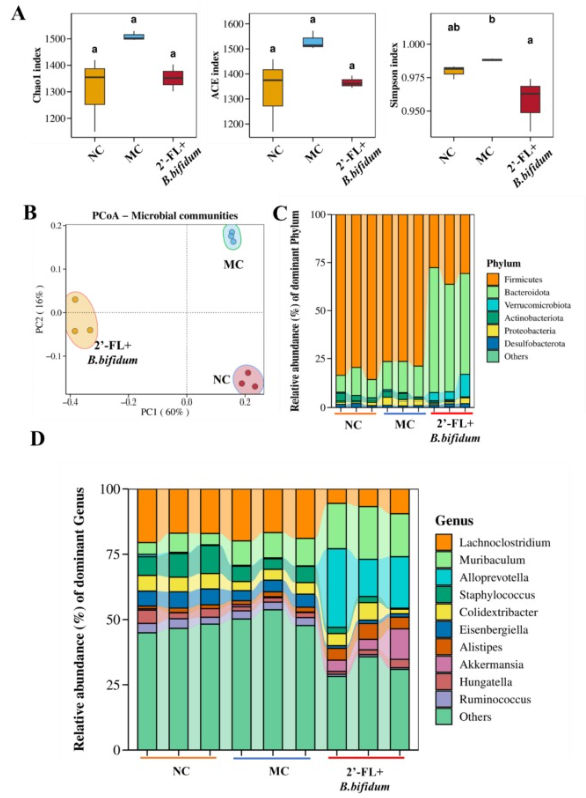
图3:2'-岩藻糖基乳糖联合双歧杆菌对小鼠肠道菌群的影响
总的来说,这项研究表明,2'-FL与B.bifidum组成的合生素通过多维度发挥作用改善小鼠便秘,包括调节肠道水吸收和胃肠肽分泌、减轻肠道炎症、修复肠道屏障、调控肠道基因转录以及重塑肠道菌群平衡等。这一发现为基于2'-FL和双歧杆菌的合生素在便秘防治中的开发与应用提供了理论支持,也为受便秘困扰的人群带来了新的希望。在日常生活中,面对便秘这一常见问题,此类基于天然成分的合生素或许能成为安全有效的干预选择,帮助人们摆脱便秘带来的困扰,提升生活质量。
参考文献:
ShanY,ZhengM,LiangW,OuyangL,WangS.2'-FucosyllactosesynbioticswithBifidobacteriumbifidumtoimproveintestinaltranscriptionalfunctionandgutmicrobiotainconstipatedmice.FoodResInt.2025;217:116840.doi:10.1016/j.foodres.2025.116840
(转自:生物谷)