2025年7月22日,科弈药业与美国生物医药企业ERIGENLLC签署独家海外授权许可协议,将其全球首个并联增强型双靶向CAR-T细胞治疗产品KQ-2003(靶向BCMA/CD19)的大中华区以外全球权益授予ERIGEN。
根据协议,科弈药业将获得1500万美元近期开发里程碑付款,并有资格获得最高达13.2亿美元的研发、注册及商业化里程碑付款,以及基于净销售额的最高8亿美元销售分成。
科弈药业保留该通用型产品在大中华区的完整权益,为后续联合开发及区域商业化奠定基础。此次合作不仅是中国创新药国际化的重要里程碑,也标志着双靶点CAR-T疗法在征服多发性骨髓瘤的征程中迈出关键一步。
双靶点CAR-T新星:KQ-2003突破多发性骨髓瘤治疗瓶颈
KQ-2003的核心价值在于其全球首创的双靶点并联设计。不同于传统单靶点CAR-T,它能同时靶向BCMA(B细胞成熟抗原)和CD19两个关键抗原。通过并联结构设计和信号域优化,该产品显著提升CAR-T细胞的持久性与抗肿瘤活性,同时降低传统CAR-T治疗后常见的复发风险。这种设计直击多发性骨髓瘤治疗的痛点——肿瘤细胞抗原逃逸导致的疾病复发。
2024年ASH年会公布数据为23例患者,其中5例无血液学指标,剩余18例可评估患者的ORR为100%,但sCR/CR为14例(77.8%),VGPR为4例(22.2%)。KQ-2003的12个月PFS率75.3%高于同类产品。
当前多发性骨髓瘤CAR-T治疗领域竞争激烈。2023年6月,驯鹿生物的全人源BCMACAR-T疗法伊基奥仑赛在中国获批上市,其在103例患者中达到96%的总体缓解率,其中74.3%达到严格意义的完全缓解。2025年1月,该产品又向新加坡提交了上市申请。
而科弈的KQ-2003作为双靶点产品,有望解决单靶点治疗后复发问题。2024年ASH年会公布科济药业赛恺泽®CR率为71.6%。根据医药魔方数据库统计,在全球BCMA/CD19双靶CAR-T研发管线中,KQ-2003排名第三,仅次于阿斯利康旗下亘喜生物的同类产品。
科弈药业携手ERIGEN:解读21亿美元合作协议的关键细节
科弈药业通过分阶段收益模式大幅降低了研发风险——1500万美元近期付款保障了研发投入的连续性,而13.2亿美元里程碑付款与8亿美元销售分成的组合则最大化长期价值,共21.35亿美元。(约153.72亿元人民币)。
在区域划分上,协议采用精准的地域差异化授权策略:ERIGEN获得大中华区以外的全球权益,而科弈保留大中华区权益。这种模式在近期国内创新药企的国际合作中渐成趋势。
协议中一个容易被忽视但极具战略价值的条款是:ERIGEN获得使用KQ-2003关键专利结构与序列开发“通用型CAR-T细胞疗法”的权利。若成功开发现货型产品,成本可降至10万美元/疗程(传统CAR-T为40万美元),大幅提升可及性。这一安排为科弈打开了通向现货型细胞治疗这一前沿领域的大门,无需自主投入高风险的平台建设即可分享未来技术红利。
技术驱动创新:科弈药业的核心平台与明星产品
科弈药业是一家专注于肿瘤免疫治疗和自身免疫性疾病创新药物研发的生物医药公司,依托三大核心技术平台——IRAE双功能抗体平台、TPEBEN纳米双抗ADC平台和K2CAR-T平台(增强型双靶CAR-T),构建了覆盖肿瘤、自身免疫性疾病等多个治疗领域的差异化产品管线。
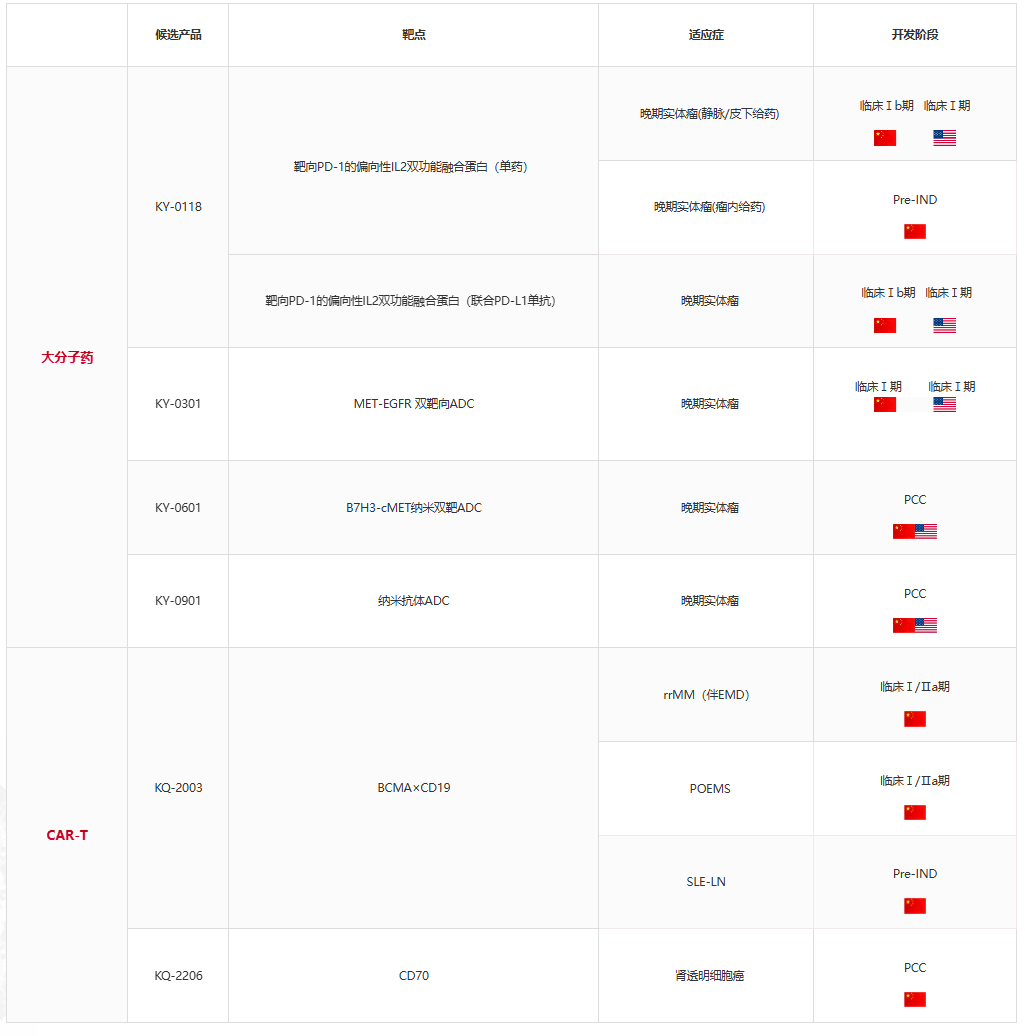
研发管线(摘录自官网)
一、增强型双靶CAR-T平台:攻克血液瘤复发难题
核心产品:KQ-2003(BCMA/CD19双靶CAR-T)
·技术突破:采用全球首创的并联结构双靶设计,同步靶向BCMA和CD19抗原,通过信号域优化增强T细胞持久性,降低肿瘤抗原逃逸导致的复发风险。
·临床进展:
oPOEMS综合征:注册性临床试验进行中,为全球首个针对此适应症的CAR-T疗法。
o系统性红斑狼疮合并狼疮性肾炎(SLE-LN):处于临床前研究阶段。
其他管线
·KQ-2002(CD19/CD22双靶CAR-T):2024年8月获CDE受理IND,拟用于治疗高级别B细胞淋巴瘤。
·RD27(BCMA/GPRC5D双靶CAR-T):临床前阶段,拓展多发性骨髓瘤靶点组合。
二、IRAE双功能抗体平台:激活实体瘤免疫应答
核心产品:KY-0118(PD-1/突变IL-2融合蛋白)
·机制创新:国内进展最快的βγ偏向性PD-1/IL-2融合蛋白之一。
·研发进度:
o单药治疗:中国临床Ⅰb期(晚期实体瘤),美国IND已获批。
o联合疗法:与PD-L1单抗(阿替利珠单抗)联用开展Ⅰ期试验,探索协同增效潜力。
·全球地位:研发进度居全球第二,仅次于罗氏同类产品。
三、TPEBEN纳米双抗ADC平台:突破实体瘤靶向递送瓶颈
核心产品:KY-0301(c-MET/EGFR纳米双抗ADC)
·技术亮点:
o全球首批进入临床的纳米双抗ADC之一。
o工艺突破:DAR4(药物抗体比)纯度达98%(行业最高),显著降低脱靶毒性风险。
·临床前数据:
o在4种CDX模型和2种PDX模型中实现肿瘤完全消退,药物递送能力为传统双抗ADC的2倍。
o毒理数据优于同类产品,安全性优势突出。
·临床进展:
o2024年12月获FDAIND批准(美国Ⅰ期),中国IND即将获批。
轻资产模式下的科弈突破:从KQ-2003到未来布局
尽管科弈药业未上市,但其财务策略可通过行业对标与交易结构透视。现金流储备依赖于KQ-2003的1500万美元首付款,该金额高于2023年细胞治疗领域平均首付额(1200万美元,麦肯锡白皮书),足以支撑近期管线推进。轻资产运营模式是其核心策略——通过海外授权转移高成本的全球开发风险。科弈的阶段性收益模型为轻资产模式显著降低现金流压力,为KY-0118及纳米ADC的临床推进留出资金空间。
红海中的机会与挑战:科弈药业的多发性骨髓瘤之旅
多发性骨髓瘤治疗领域已成红海,国内竞品包括传奇生物BCMACAR-T、驯鹿生物伊基奥仑赛,以及科济药业赛恺泽®。
在临床、监管以及费用上还有很多挑战:科弈KQ-2003的双靶点设计虽在理论上可解决抗原逃逸导致的复发问题,但需III期大规模试验验证早期100%缓解率的可持续性(当前数据源于研究者发起试验)。根据2024年FDA《细胞治疗指南》,监管建议双靶点产品提供靶点贡献的科学基础,但不是强制要求。CAR-T疗法患者自付费用中位数达18万美元(商业保险通常覆盖90%+,但Medicare仅覆盖65%)。
文章内容仅供参考,不构成投资建议。投资者据此操作,风险自担,关于对文中陈述、观点判断保持中立,不对所包含内容的准确性、可靠性或完整性提供任何明示或暗示的保证。请读者仅作参考,并请自行承担全部。