转自:生物谷
如果把细胞比作一座城市,能量就是维持城市运转的电力。传统观念认为,产生能量的“发电厂”位于细胞质深处,而最新研究却揭示:癌细胞竟将部分“电厂”直接搬到了细胞膜上。
2022年全球新发癌症病例超2000万,中国每分钟就有7人被确诊,其中乳腺癌、肺癌、肝癌和结直肠癌合计占比超五成。这些癌种均表现出显著的“嗜糖”特征——即使在氧气充足时,也优先通过糖酵解快速生产ATP,这一现象被称为Warburg效应。过去百年,科学家们知晓这一现象的存在,却始终未能阐明其背后的机制。
近日,一篇发表在国际杂志NatureCommunications上题为“Self-organizingglycolyticwavestunecellularmetabolicstatesandfuelcancerprogression”的研究报告,为这一世纪谜题提供了全新视角。该研究由约翰・霍普金斯大学医学院等机构的科学家完成,他们通过实时成像技术,捕捉到了糖酵解酶在细胞膜上“排队涌动”形成动态波的过程。

糖酵解酶在细胞膜上形成“动态能量波”
传统生物化学认为,糖酵解酶存在于细胞质中,糖酵解过程也发生在细胞质内。而该研究团队通过一系列实验,颠覆了这一认知。
研究人员以MCF-10A系列乳腺上皮细胞(包括M1-M4四株恶性程度递增的衍生细胞)、HL-60中性粒细胞及七种实体瘤细胞系(来自胰腺、肺、乳腺、结肠、肝等)为研究对象,采用荧光蛋白标记了糖酵解通路中的关键酶——包括醛缩酶、己糖激酶(HK)、磷酸果糖激酶(PFK)、甘油醛-3-磷酸脱氢酶(GAPDH)、烯醇化酶(ENO)、丙酮酸激酶(PK)等六种酶,并结合Lifeact(一种标记新形成的分支F-肌动蛋白的分子),通过激光共聚焦显微镜(如ZeissLSM780、880)和TIRF显微镜,在控制温度、湿度和CO₂的活细胞成像舱中,连续拍摄细胞基底面的动态变化。
结果发现:这些糖酵解酶并非均匀分散在细胞质中,而是在细胞膜/皮质区自组织形成动态波。这些“糖酵解波”宽度约0.5微米,以2-5微米/分钟的速度推进,且与F-肌动蛋白波高度重叠——两者的波长、带宽、速度和持续时间等参数高度相关,表明糖酵解波与肌动蛋白波存在紧密耦合。
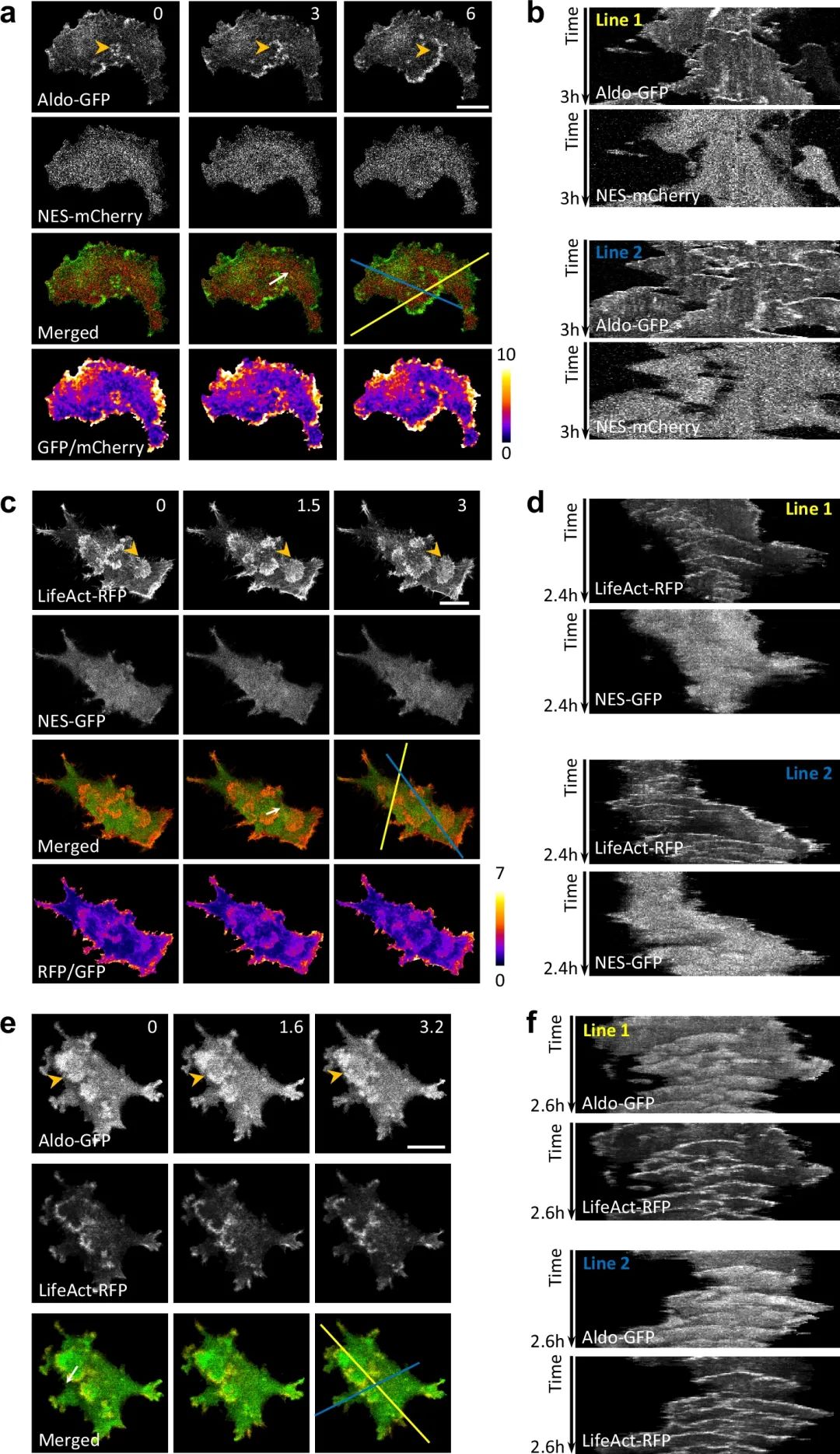
肌动蛋白波中醛缩酶的富集
为验证这一现象并非荧光标记的artifacts,研究人员通过免疫荧光染色观察固定细胞中的内源性糖酵解酶,发现内源性GAPDH、醛缩酶、烯醇化酶-1等同样在肌动蛋白波中富集,且即使在未表达LifeAct的细胞中,糖酵解波仍清晰可见,进一步证实了糖酵解波的真实性。
糖酵解波的“开关”与能量产出
随后,研究团队通过多种干预手段,探究了糖酵解波的调控机制及其与能量产出的关联。
信号刺激增强糖酵解波活性:当用EGF(表皮生长因子)和胰岛素刺激细胞时,醛缩酶、PFK等酶形成的糖酵解波数量在30分钟内增加约2.5倍,并持续数小时;同时,细胞内ATP水平(通过iATP生物传感器监测)上升约20%,表明糖酵解波活性增强可直接促进能量产出。
破坏结构或信号阻断糖酵解波:用LatrunculinA(LatA)破坏肌动蛋白结构,或用LY294002抑制PI3K信号通路,糖酵解波会立即消失,酶退回细胞质,同时ATP水平下降25%;若先阻断PI3K,再加入EGF和胰岛素,ATP水平不再上升,说明糖酵解波的维持依赖肌动蛋白结构和PI3K信号。
能量来源的特异性:通过糖酵解抑制剂(2-脱氧葡萄糖+3-溴丙酮酸,简称DB)和氧化磷酸化(OXPHOS)抑制剂(寡霉素+抗霉素+鱼藤酮,简称OAR)对比实验发现:抑制糖酵解后,ATP水平下降70%以上;而抑制氧化磷酸化,ATP仅下降不到10%。此外,线粒体并未出现在糖酵解波中,进一步证实膜/皮质区的ATP主要由糖酵解波贡献。
“单酶招募”触发连锁反应
接着,研究团队通过化学诱导dimerization(CID)和光遗传学技术,人为将单个糖酵解酶招募到细胞膜,观察其对细胞行为的影响。
在MCF-10AM3细胞中,用CID技术将PFK招募到膜上,不仅触发了细胞铺展和动态actin斑块的形成,还诱导了醛缩酶向膜的共招募,表明膜上糖酵解酶可组装成多酶复合体。
在HL-60中性粒细胞中,通过光遗传学手段将醛缩酶招募到膜上后,原本静止的细胞迅速极化并加速迁移,迁移速度、细胞面积和极性均显著增加,证实膜上糖酵解酶的富集可直接增强细胞的动态行为。
这些结果表明,细胞膜上的糖酵解波并非随机分布,而是通过酶的协同招募形成局部“能量灶”,为细胞活动提供即时能量。
癌症恶性程度与糖酵解波的关联
最后,为探究糖酵解波与癌症进展的关系,研究团队对不同恶性程度的细胞系进行了系统分析。
MCF-10A衍生细胞系(M1-M4):从低度恶性的M1到高度恶性的M4,糖酵解波的频率、ATP水平及糖酵解供能比例呈线性上升;用PI3K抑制剂处理后,M3细胞(高转移性)的ATP下降25%,而M1细胞(低恶性)仅下降15%,表明高转移性细胞更依赖糖酵解波供能。
七种实体瘤细胞系:包括胰腺癌(AsPC-1)、肺癌(Calu-6)、乳腺癌(MCF-7、MDA-MB-231)等,糖酵解波活性与ATP水平、糖酵解供能比例呈强正相关(R²>0.9)。其中,波活性最高的HCT116(结肠癌细胞)和MDA-MB-231(乳腺癌细胞),糖酵解供能占比超80%;而波活性最低的MCF-7(乳腺癌细胞)仍主要依赖氧化磷酸化。
高耗能过程依赖糖酵解波:抑制糖酵解后,高波活性细胞的巨胞饮(nutrient摄取)和蛋白合成(通过KikGR光转换蛋白监测)几乎完全停滞,而线粒体电位不受影响,表明这些过程依赖糖酵解波提供的“即取即用”型ATP。
小结
该研究首次揭示:糖酵解酶在细胞膜/皮质区自组织形成动态波,通过局部富集酶(浓度可提升20倍以上)加速糖酵解,为癌细胞的高耗能过程(迁移、巨胞饮、蛋白合成等)提供即时能量。这一机制解释了Warburg效应的亚细胞基础——癌细胞并非整体“偏爱”糖酵解,而是通过糖酵解波的增强,实现能量代谢的“局部特化”。
更重要的是,糖酵解波的特异性(仅活跃于高转移性癌细胞)为肿瘤治疗提供了新思路:无需全面抑制糖酵解(避免影响正常细胞),只需阻断糖酵解酶向膜的招募或破坏波的结构,即可切断癌细胞的“能量专线”,实现精准干预。
这项研究不仅刷新了人类对细胞代谢空间调控的认知,更为癌症代谢靶向治疗开辟了全新路径。
参考文献:
Zhan,H.,Pal,D.S.,Borleis,J.etal.Self-organizingglycolyticwavestunecellularmetabolicstatesandfuelcancerprogression.NatCommun16,5563(2025).doi:10.1038/s41467-025-60596-6