Matrix mechanics and water permeation regulate extracellular vesicle transport是发表于《Nature Nanotechnology》的一篇文章,细胞外囊泡在细胞间通信中起着重要作用,但它们如何在细胞外基质中运输一直是个谜。通常,细胞外囊泡的尺寸大于基质的网孔尺寸,然而它们却能在其中顺利通行。近期的研究发现,基质力学和水渗透对细胞外囊泡的运输起到了关键的调节作用。接下来,我们将深入了解这一发现的具体内容和意义。
*本文只作阅读笔记分享*
一、引言
细胞外囊泡(EVs)是细胞衍生的颗粒,存在于细胞外基质(ECM)中,直径通常为50 - 500nm。然而,ECM的网孔尺寸通常小于EVs, ECM具有多种力学性质且平均网孔尺寸常小于EVs。但EVs能在天然纳米多孔基质中轻易运输,例如从小鼠间充质 stromal 细胞(MSCs)制备的EVs,标记为CD63 - K2S(K2S - EVs),可在脱细胞基质中观察到其分布和释放。
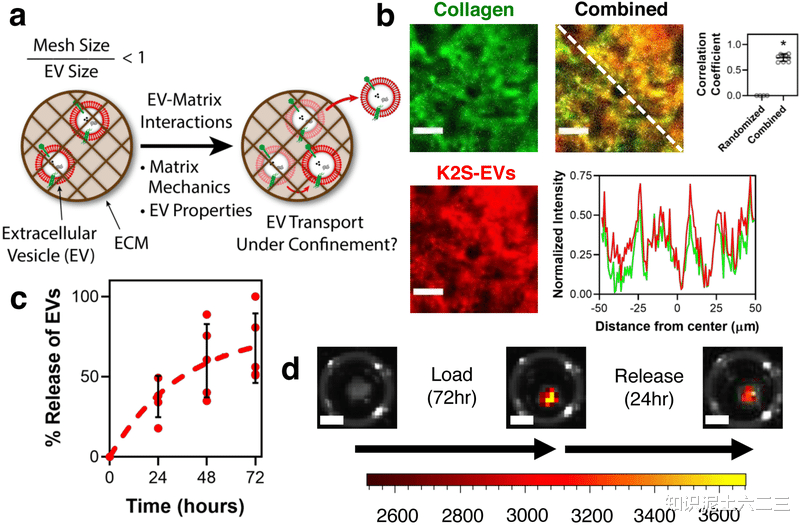
二、基质力学对EVs运输的调节
(一)实验设计
为确定基质力学是否介导EV运输,构建了一系列具有不同力学性质的藻酸盐基水凝胶,其力学性质与组织中存在的相似。水凝胶可通过二价阳离子或点击化学进行交联,且交联后的G可调。物理交联导致应力松弛水凝胶,共价交联导致弹性水凝胶。此外,还制备了藻酸盐和胶原-I聚合物的互穿网络(IPN)水凝胶,其G可独立于胶原-I浓度进行调节。
(二)实验结果
水凝胶的性质对EV释放的影响:水凝胶的G和交联类型会影响EVs的释放,应力松弛水凝胶中G越高,EVs的释放越多,这种效应在其他细胞来源的EVs中也存在,而脂质体没有这种现象。

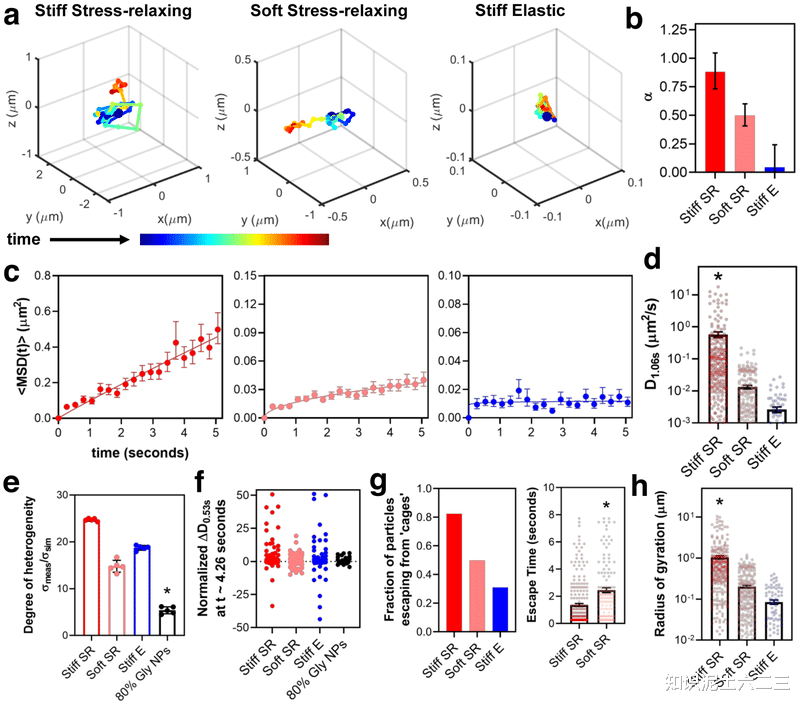
EV在不同水凝胶中的运输情况:在僵硬的应力松弛基质中,EVs的运输更接近溶液中的扩散运输(α接近0.88),而软应力松弛基质中的EVs扩散系数(D1.06s)显著降低且呈亚扩散运输(α约为0.49),僵硬弹性基质中的EVs亚扩散运输更明显(α约为0.045)。
基质对EV运输运动的影响:应力松弛基质中的EVs运输具有“动态异质性”,僵硬基质驱动EVs在轨道内的运输运动波动,使EVs能够更快地逃脱“笼子”的限制。在僵硬应力松弛基质中,更多的EVs能够逃脱笼子且速度更快(约1.3秒),僵硬应力松弛基质中的EVs探索的空间也更大(具有更高的回转半径Rg)。
三、EV内在性质对其运输的驱动
(一)实验设计
通过冻干和再水化实验研究EV膜结构完整性对运输的影响,通过添加整合素结合配体RGD和药物处理研究EV表面相互作用和肌动球蛋白收缩性对运输的影响,通过检测ATP浓度和部分耗尽细胞ATP研究EV运输的代谢机制,通过添加水通道蛋白抑制剂和基因沉默研究水渗透对EV运输的调节作用。
(二)实验结果
膜结构完整性的影响:冻干后的EVs不能从僵硬的应力松弛水凝胶中释放更多,扩散系数D1.06s降低约10倍,α降至约0.25,表明完整的膜结构对EV的机械敏感运输是必要的。
其他因素的排除:排除了EV表面相互作用、肌动球蛋白收缩性和代谢活性对EV运输的影响。
水渗透的调节作用:水通道蛋白1(AQP1)介导了EV的运输,AQP1缺失会使EV的杨氏模量增加,变形能力降低,从水凝胶和脱细胞基质中释放减少,扩散系数D1.06s降低约3倍,但α不变,逃脱笼子的时间增加。

四、结论
EVs能在聚合物基质中运输,尽管其尺寸大于基质的平均网孔尺寸,基质应力松弛允许EVs逃脱聚合物网络形成的笼子,僵硬基质增加了EVs的运输运动波动,从而增强了EVs的运输能力。AQP1使EVs更具变形能力,从而促进其在基质中的运输。这一发现对于理解EV在ECM中的运输行为以及开发治疗性EV的递送策略具有重要意义。

参考文献:
Lenzini S, et al. Matrix mechanics and water permeation regulate extracellular vesicle transport. Nat Nanotechnol. 2020 Mar;15(3):217-223.