能源的生产以及利用方式随着现代社会的发展不断发生变革。人们日益增长的能源需求和对环境问题的密切关注促使能源的使用方式从原有的以石油、煤炭等化石能源以及核能为主的发电向纯净的可再生能源发电转变。
风能,太阳能等可再生能源由于资源总量极大,分布广泛,绿色无污染等特点,吸引了越来越多的国家和地区的参与到其中,并在近些年迅速发展。

然而可再生能源容易受到自然因素的影响,在不同时间和空间上分布不均匀,使得能源很难得到有效的利用。
为了解决以上问题,将可再生能源转化为电能并发展稳定可靠的储能系统是行之有效的方法。
电化学类储能相比于机械类储能和热储能等方式具有易操作、污染少、高能量转化效率以及能量密度和功率密度高等优点,被广泛应用于交通领域、电子设备以及大规模电网储能中。
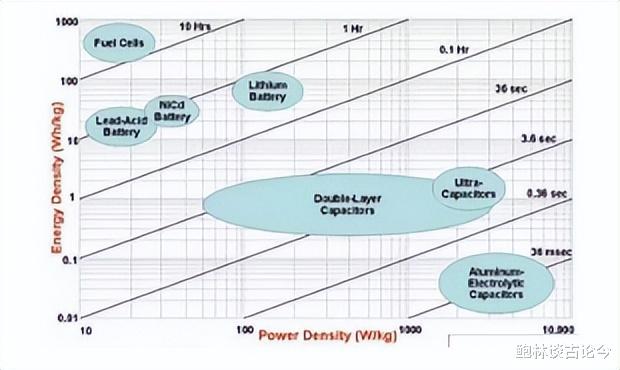
自从1859年铅蓄电池首次问世以来,电化学储能技术一直向着高效、安全、经济可行、环境友好的方向发展,如今,电化学类储能中尤以超级电容器、燃料电池和二次电池最为突出,不同的电化学储能技术的能量密度,功率大小等方面的存在着巨大的差异,因此也被应用在不同的方面。
电化学储能技术的概述超级电容器
超级电容器拥有快速的充放电特性和高达万次以上的循环寿命,能通过物理和化学的形式储存电荷,因此可以和电池一样用于能量储存。

在目前已知的众多电极材料中,碳材料的内部孔隙极多,比表面积大,导电率高、稳定性好,因此被广泛应用作双电层电容器电极材料。
而赝电容器则是通过纳米结构的金属磷化物,氧化物,氢氧化物等电极活性材料在充放电时发生极快的氧化还原反应来进行储能的。
通常,由于双层电容器地充放电过程只能利用电极活性材料的表面,因此能够利用体相充放电的赝电容器充放电时产生的电容更高,但是功率性能和循环性能更差。

超级电容器的能量密度较小,远低于蓄电池和燃料电池,但是它的充放电速度极快,因此功率密度极大,并且能够循环万次以上,在-40℃的低温和70℃的高温下也能够正常地工作。
目前,超级电容器已经被广泛的应用在了各个方面,比如:电网电力输送,汽车与公共交通,不间断电源(UPS)以及起重机等工业设备等。
但是相对于蓄电池来讲,较低的能量密度限制了它的在大规模储能系统中的使用。
燃料电池
燃料电池(Fuel Cells)是以H2,天然气以及醇类等燃料作为负极,发生氧化反应;正极的氧气作为氧化剂发生还原反应。
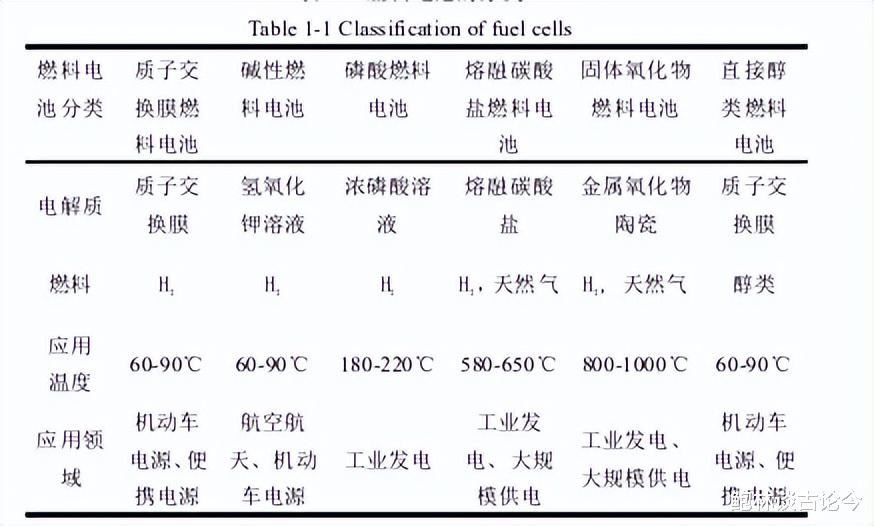
燃料电池的正负极被夹在电解质周围,正负极本身不发生氧化还原反应,除了传导电子外还负载着氧化还原催化剂,促进反应动力学的提升。
燃料电池的发电效率很高,理论上可以达到90%左右,而在实验室以及实际应用过程中由于极化等原因的限制导致效率降低,但是实际效率仍在50-70%之间。
燃料电池的能量密度远高于其他类型的电化学储能装置。除此以外,燃料电池的负极燃料为氢气,甲醇等,而且正负极都通过电化学原理发电,产物为水,因此在电池工作过程中不会产生有害产物从而大幅度减轻对环境的污染。

目前燃料电池只有小规模应用于一些固定式的能源站、客车等交通运输等领域,未来的发展仍需要付出更大的努力。
二次电池
以铅酸电池,锂离子电池等为代表的二次电池储能系统正逐渐成为主流的储能技术,从手机电脑、汽车到大规模电网储能都有着广泛应用。
二次电池是利用化学反应的可逆性,使得电能和化学能之间能够互相转变从而达到储能的目的。

氧化还原液流电池在充放电过程中,正负极的电化学反应均在电解液中进行,当结束充放电后,再通过泵将电池内部的反应物抽走,同时,新的待反应的电解液会被抽到电池室中接着进行电化学反应实现充放电。
当前相对成熟且获得应用的液流电池主要是是全钒液流电池。它的正极和负极的反应物分别是充满VO2+/VO2+和V2+/V3+电对的硫酸溶液,充放电过程中正负极以及全电池的反应式如下:
负极:
V2+-e-V3+
正极:
VO2++2H++e-VO2++H2O
电池反应:
VO2++2H++V2+VO2++V3++H2O
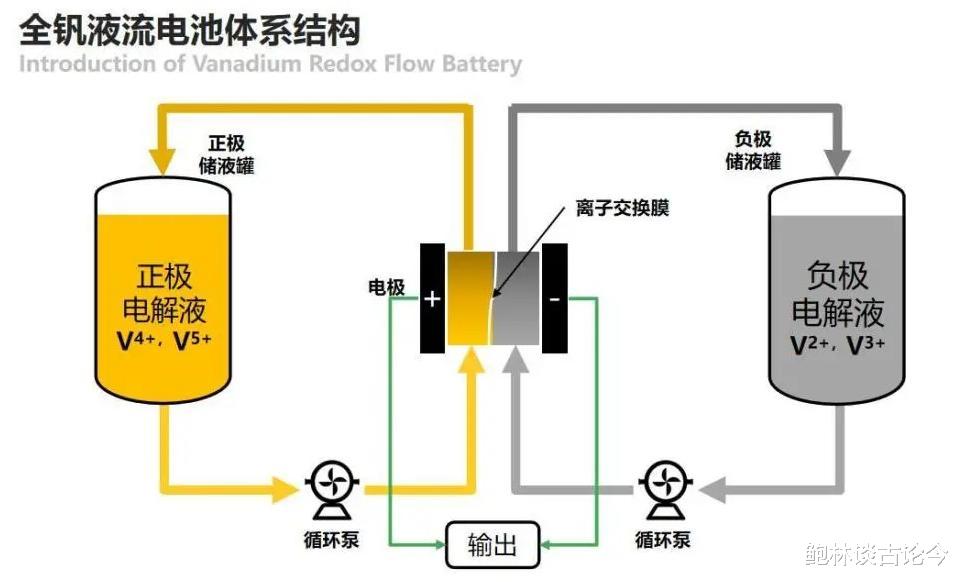
由于氧化还原液流电池独特的充放电机制和结构,相比于传统的固态活性材料的二次电池有一些显著的优势。
首先,液流电池的能量转换过程中使用液体作为活性物质以及电解质,可以在不需要改变电池构造的基础上通过改变电解液体积调节储能的容量,当需要增加输出功率时只要增加电堆的面积以及数量即可。
其次,液相反应避免了传统蓄电池充放电所导致的固相电极结构改变和相变,使液流电池使用寿命大大增加,相对减少了维护次数,节约成本。
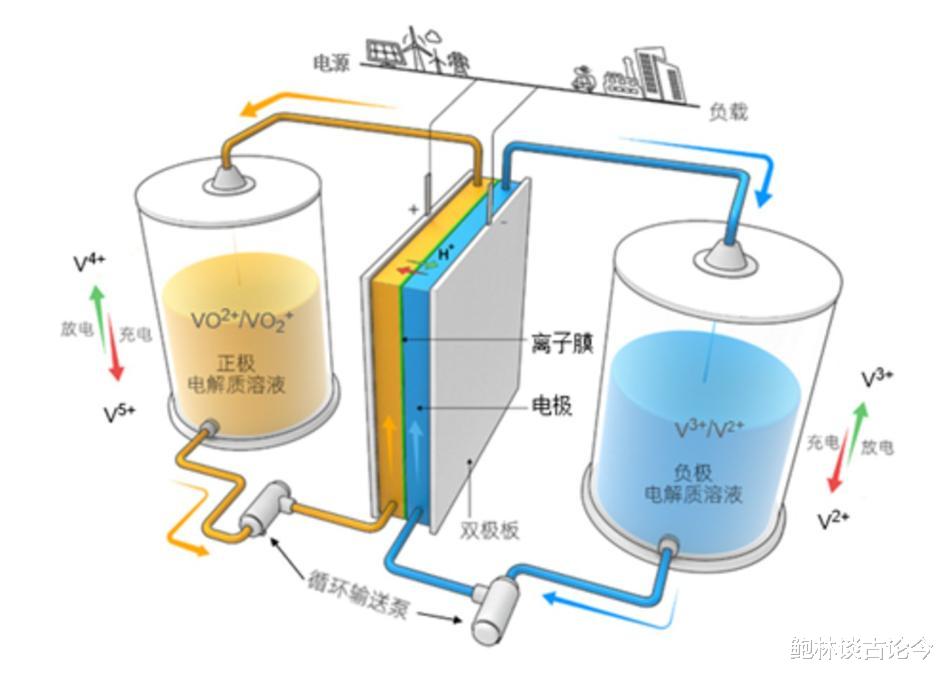
水溶液作为电解质还具有无引燃危险的高安全性特征。目前,氧化还原液流电池大多用在大规模储能装置以及电网调峰等领域。
但是液流电池体积太大、能量密度偏低(15-50 Wh kg-1),离子交换膜的老化等问题也从另一个方面影响使用寿命,这些问题限制了氧化还原液流电池在更多领域的使用,因此仍需要深入地研究才能使液流电池获得更广泛的应用。
锂离子电池由碳材料、合金材料以及氮化物等作为活性材料的负极,钴酸锂,钛酸锂以及磷酸铁锂等作为活性材料的正极,有机电解液以及隔膜组成。
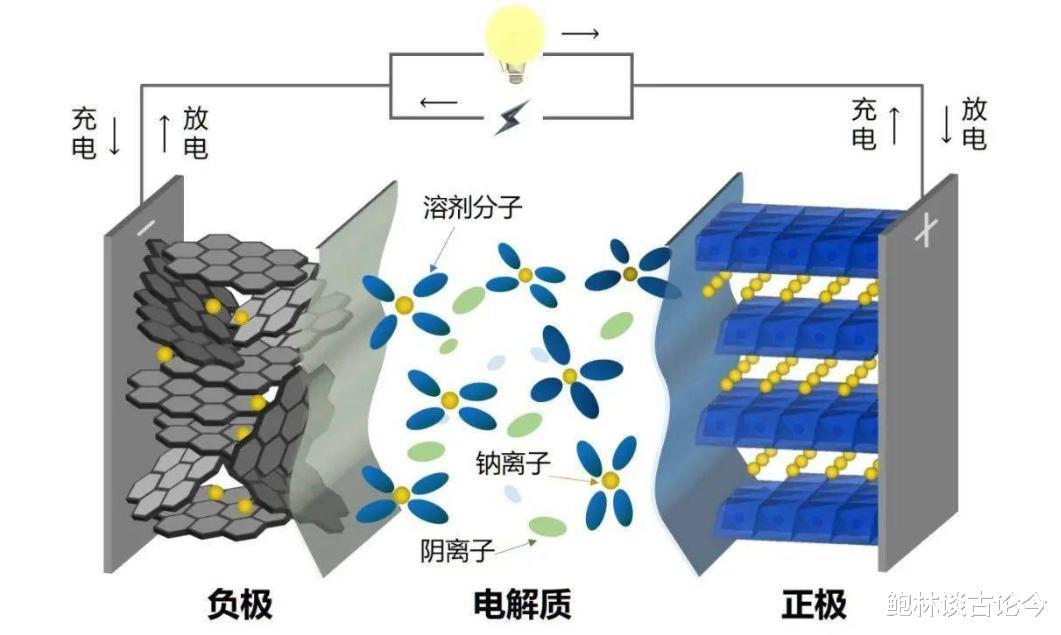
由于锂(Li)是最轻的金属并且具有最低的标准还原电位(-3.04 V vs.SHE),这使得锂离子电池具有极高的比容量以及放电电压,使锂离子电池具有高能量密度的突出优势。
以钴酸锂//石墨电池为例,说明锂离子电池充放电过程发生的反应,其充放电反应式为:
负极:
Lix C6 x Li++C6+xe
正极:
x Li++Li1-x CoO2+xe-LiCoO2-
电池反应:
Lix C6+Li1-x CoO2 LiCoO2+C6
锂离子电池具高循环寿命,高充放电效率高,低自放电,高输出功率高等显著优势,因此在近些年获得迅速发展和广泛应用。

除了作为各种大规模电力储能电源系统外,锂离子电池电动车上作为交通动力电源以及手机,笔记本上作为移动通信电源已经十分普及,大大方便了日常生活。
但是锂离子电池较高的成本,严苛的组装环境以及有机电解液带来的安全隐患等也是它深入广泛的实际应用需要应对的问题。
铅酸电池(VRLA)最早在1859年发明,是最早商用化的二次电池,直到现在还在汽车,船舶等领域有着广泛使用。
铅酸电池中在电池放电时正负极活性材料均与电解质硫酸发生反应,并生成硫酸铅(PbSO4),充电时则发生逆向反应,铅酸电池充放电发生的反应如下:
负极:
Pb+SO42-PbSO4+2e-
正极:
PbO2+SO42-+4H3O++2e-PbSO4+6H2O
电池反应:
Pb+PbO2+2SO42-+4H3O+2PbSO4+6H2O

铅酸电池可以提供2.1 V的平均放电电压,但是由于作为电极活性材料的铅的电化学当量较高,而硫酸也作为活性物质的一部分,所以导致比容量较小,能量密度只有30-50 Wh kg−1。
除此以外,铅酸电池循环寿命短,材料利用率低,并且电极材料和生产原料毒性极大,以上这些缺陷尤其是污染性的特征限制了它未来的大规模应用。
随着储氢合金的发现,铅酸电池在很多领域被使用高浓度KOH水溶液为电解液的镍氢电池(MH-Ni)取代。
使用水溶液作为电池的电解液离子电导率高,成本远低于有机电解液,并且无需担心发生爆炸着火等危险,但是水溶液体系本身较低的电化学窗口制约了能量密度,因此以铅酸电池和镍氢电池为代表的水溶液电池体系的综合性能还需要进一步提升。

低温环境下电池性能的分析
不同的环境因素会使电池的性能发生变化,在这些环境因素中温度无疑是影响最大且最广泛的一个。
当环境温度升高,电池的功率、充放电电压平台等电化学性能会相应改善,但是如果升温过高,那么就会导致电池内部的化学平衡被破坏,随之发生一系列副反应,从而导致电池各方面的性能发生严重衰退,循环寿命缩短甚至引起热失控。
但是当环境温度降低,电极材料的反应速率,电池的输出电压以及输出功率等性能都会随之下降,当下降到一定温度,电池甚至会发生严重断电,这很大程度上限制了高纬度、高海拔等寒冷地区的各种电子设备以及大规模储能装置的使用。

低温下电池的能量输出降低,功率衰减,充放电速度减慢,这些问题也会限制电动车启动,并使行驶里程大大减少,如果要保证设备正常工作则是需要更多的电池组来使发动机启动,无疑大大增加了成本。
目前,适用于极低温度下的商用二次电池主要是锂离子电池和镍氢电池。导致二次电池在低温下的电化学性能发生衰减甚至无法继续使用的原因有很多。
以镍氢电池为例,当电池所处环境的温度降低,会导致镍氢电池中电化学反应的极化增加,而强极化会导致镍氢电池的性能下降。

电池低温性能的改进
由于各种电池在低温下性能急剧下降,严重影响了电池在一些极端寒冷环境下的正常使用。
为了解决电池的低温性能衰减问题,人们除了在电池外部进行加热和隔热设计以外,还对电池本身的电极材料和电解液进行了一系列的改进,比如对电极材料进行元素掺杂,表面处理,包覆或者通过添加其他物质优化电解液组成等。
实验结果证明,这些改进方法能够明显降低镍氢电池和锂离子电池在低温下电化学性能的衰减。除此以外,研究人员还致力于研究新的抗冻性能好的电极材料或电池体系。
对于锂离子电池体系而言,低温性能差的主要原因是电解质的离子电导率降低。

Yang等通过溶解双(三氟-乙磺酰)亚胺锂(LiTFSI)到三氟乙酸乙酯(ETFA)溶剂中成功制备了一种新型ETFA电解质。
在低温条件下,ETFA溶剂与Li+之间的弱亲和力促进了溶剂的溶解过程。基于ETFA电解质,LMO锂离子电池在−40°C的温度下容量保持率高达98%,而LTO锂离子电池在−50°C的温度下容量保持率高达91%,即使在-70°C的温度还能有46%的容量保留。
LMO//LTO和NMC//LTO的全电池也表现出优异的倍率性能、高能量密度和优越的低温性能。
Wang等人报道了一种可应用于各种低温环境的锂离子电池结构,当温度低于零度,它可以利用放电产生的热量进行自加热,不需要外部保温设备或者改变电解液成分。

自加热机制产生了有利于高放电和充电功率的电化学界面。
实验证明,在-20℃和-30℃的温度下,这种电池结构内部能在几十秒内迅速升温,并且这个过程中电池容量仅仅损失3.8%和5.5%。
这种自动加热的全气候电池在50%的电量剩余和-30℃的情况下,放电以及再生功率分别为1061 W kg-1和1425W kg-1,是目前最先进的低温锂离子电池的6.4-12.3倍。
而对于镍氢电池而言,储氢合金负极表面的腐蚀或氧化层以及低温状态下大幅下降的化学反应速度严重阻碍了电池的低温性能,限制了镍氢电池在极端环境下的应用。
Zhou等人采用N2H4、Na H2PO2、Na BH4等还原剂对镍氢电池负极活性材料MmNi3.7Co0.7Mn0.3Al0.3合金进行双热碱处理,获得了优异的低温和瞬时高速率输出性能。

他们发现在-40℃时,合金表面的电荷转移过程是影响电化学性能的主要控制步骤。SEM和EDS结果表明,Al和Mn的优先溶解形成了高电催化活性的富镍层和富钴层,同时通过热碱双相处理能有效去除储氢合金表面的氧化物。
因此,处理后的合金的阻抗明显降低,表现出更好的活化性能、高速率放电性能和瞬时高速率输出性能。
Li等人通过在120℃下的水热硫化法,在贮氢合金表面有效地合成了稳定多孔的Ni3S2纳米片阵列。
由于这些Ni3S2镀层具有高导电性、优异的电催化活性和结构稳定性,通过包覆抑制了贮氢合金表面的腐蚀或氧化层的形成,使得制备的储氢合金在低温下的容量以及大功率性能显著提高。

经过研究人员的不断改进,低温锂离子电池和镍氢电池的电化学性能不断提升,但是低温锂离子电池生产的制造制作工艺难度系数大,还要适应各种环境的难度系数,并且只能定制,成本极高。
而低温镍氢电池即使经过改进,在低温下性能仍然衰减严重,在-40℃下的容量衰减超过30%,并且大电流下的性能极差。
