
01、摘要
恶性胶质瘤(Glioblastoma)是一种高度恶性的原发性脑癌,总体生存率很低,治疗方案也很有限。最近在新的癌症免疫相关治疗策略方面的突破激发了人们对患者肿瘤免疫系统识别和消除恶性胶质瘤的兴趣。在这里,我们讨论了影响恶性胶质瘤肿瘤靶向治疗的主要因素,重新认识靶向治疗在恶性胶质瘤治疗中的作用,旨在为开发针对恶性胶质瘤患者的新型靶向治疗策略提供参考。
02、背景
恶性胶质瘤是源自神经上皮的肿瘤,占颅脑肿瘤的40-50%,是最常见的颅内恶性肿瘤。在2007年世界卫生组织(WHO)的分类中,主要的胶质肿瘤类群包括星形细胞肿瘤、少枝胶质细胞肿瘤、少突星形细胞肿瘤、室管膜肿瘤以及神经元和混合神经元-胶质肿瘤(如神经节胶质瘤)[1]。其中,星形胶质瘤是胶质瘤中最常见的一种,约占40%左右。病理分型为Ⅰ级(星形细胞瘤),Ⅱ级(星形母细胞瘤),Ⅲ~Ⅳ级(多形胶质母细胞瘤)。Ⅰ~Ⅱ级星形细胞瘤为低度恶性,起病缓慢,肿瘤在CT及MR的表现多为实性或囊性,边界不清,肿瘤实性部分或囊性结节均可强化。Ⅲ~Ⅳ级的多形胶母细胞瘤起病快速,为恶性度最高的肿瘤,多生长于大脑半球,因肿瘤生长迅速,肿瘤中心可有多处坏死及出血,CT及MR均明显强化。随着过去几十年对神经胶质瘤研究的进展,产生了越来越多争对胶质瘤的治疗方案,包括药物靶向治疗和免疫治疗等。但由于受到一些机体生物学因素的影响,导致在胶质瘤的治疗过程中产生了不同程度的耐药性。因此,我们将探讨影响胶质瘤靶向治疗耐药的具体因素,有助于对胶质瘤免疫治疗的新认识。
03、血-脑屏障阻止免疫细胞进入脑组织
血脑屏障是指脑毛细血管壁与神经胶质细胞形成的血浆与脑细胞之间的屏障和由脉络丛形成的血浆和脑脊液之间的屏障。血脑屏障能够阻止某些有害物质、亲水大分子物质经过血液循环进入脑组织,同时也可以维持脑组织所需的氧气、营养物质等。但血脑屏障在免疫反应过程中也有一定的影响,如在肿瘤免疫反应过程中血脑屏障会阻止免疫细胞进入脑组织,使得大部分免疫细胞均无法透过血-脑屏障,只有少量天然免疫细胞可以顺利通过,但不足以引起级联放大式的免疫应答。使得以注射外源性抗原引起机体对肿瘤的特异性免疫反应的主动免疫治疗胶质瘤存在一定的局限性。

血-脑屏障结构示意图[2]
04、不同亚型的胶质瘤细胞的异质性
胶质母细胞瘤(GBM)是恶性程度最高、侵袭性最强的IV级胶质瘤。GBM患者的平均生存期约为15个月,5年生存率不到5%。通过对胶质母细胞瘤的基因转录组学测定,根据不同种基因突变类型,美国癌症基因组图谱(TCGA)和中国人群脑胶质瘤基因图谱(CGGA)将胶质瘤划分为前神经元型、神经元型、经典型和间质型,每种亚型的常见基因突变类型均不同,经典型表现为EGFR基因突变;前神经元型最常见PDGFRA或IDH1/2基因突变;间质型主要为NF基因突变;与经典型相似但是具有更高的TP53突变EGFR扩增或过表达; NEFL, GABRA1, SYT1, SLC12A5这些神经元的标志也会表达[3-4]。因此,在不同亚型中的不同突变靶点也存在较大的异质性,导致难以找到可以囊括大部分靶点和抗原的治疗方案,这也是当前靶向和免疫治疗方案少和效果欠佳的原因之一。
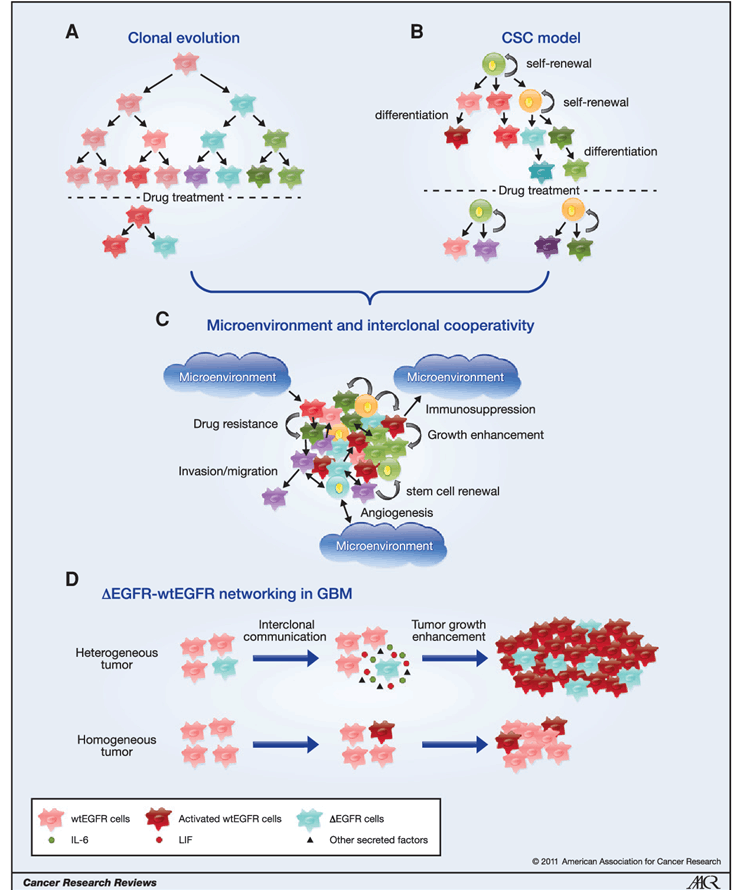
GBM异质性的起源与维持[5]
05、肿瘤微环境中的免疫抑制细胞
胶质瘤微环境中存在CD4+TILs和CD8+ TILs。据研究显示,高级别胶质瘤(III级和IV级)中CD8+TILs的数量明显低于低级别胶质瘤(II级)。相比之下,高级别胶质瘤中CD4+TILs的数量高于低级别胶质瘤。在III级和IV级胶质瘤患者中,CD4+和CD8 +TILs的数量没有显著差异。CD4+ TILs/CD8+TILs比例越高的胶质瘤患者,总生存期越短[6]。除此之外,GBM微环境中存在大量可以表达转录因子FoxP3的调节性T细胞(Treg),而低级别胶质瘤微环境中Treg细胞则较少,表明CD4+TILs细胞、CD8+TILs细胞和Treg细胞数目均可影响胶质瘤的免疫应答,而胶质瘤微环境中免疫细胞也远非仅局限于上述几种[6]。

肿瘤浸润淋巴细胞(TIL)在胶质母细胞瘤中的预后意义[6]
06、获得性突变
BRAF是一种被鼠肉瘤病毒(RAS)激活的快速加速纤维肉瘤(RAF)激酶,可激活丝裂原活化蛋白激酶激酶(MEK)通路。BRAF是泛实体瘤患者的主要致癌驱动基因之一。癌细胞中超过90%的激活BRAF突变发生在V600氨基酸的激酶结构域,最常见的是导致V600E突变。在2023年首次报道一例带有BRAF V600E突变的胶质母细胞瘤患者[7]。在一开始使用黑色素瘤、非小细胞肺癌和间变性甲状腺癌的标准治疗方法BRAF+MEK联合抑制治疗患者并获得了不错的反应,但随后通过组织学转化为胶质肉瘤并获得致癌KRAS G12D和NF1 L1083R突变而产生治疗耐药性[7]。这个病例首次提供了KRAS G12D/NF1 L1083R异常的组织学转化与原发性BRAF V600E改变的胶质母细胞瘤同时发生的证据,这是在BRAF和MEK联合抑制的情况下,一种以前未被认识到的获得性耐药机制。
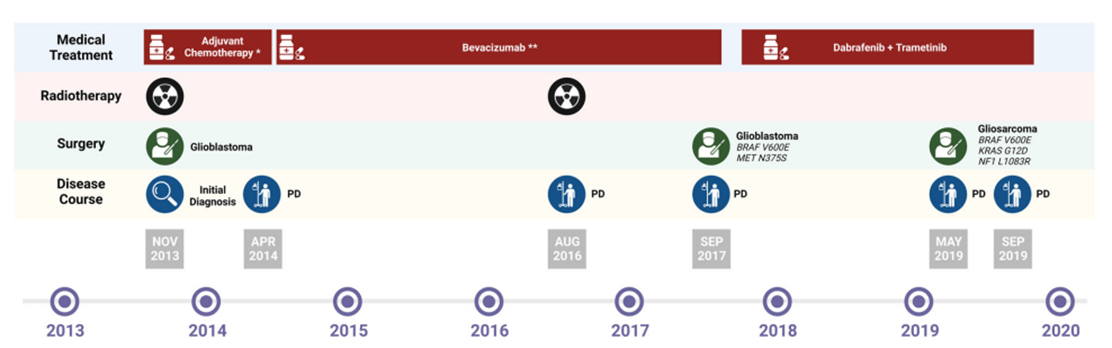
胶质瘤治疗方式的演变[7]
07、结论
目前,脑胶质瘤的治疗方法主要还是以手术和放化疗为主,药物的靶向治疗和免疫治疗选择较少。通过从肿瘤耐药机制的角度进行分析,为后续靶向和免疫治疗药物的研发提供一些参考价值。最后,建议患者需要遵医嘱用药,并且定期复查,以便于医生能够及时调整治疗方案。同时,在日常生活中要注意休息,避免过度劳累,以免加重病情。
08、飞朔生物胶质瘤基因检测
飞朔生物胶质瘤基因突变检测,有利于科学精准评估个体患胶质瘤的风险并辅助分型,制定个性化管理方案等。

参考文献
[1] Acta Neuropathol. 2007 Aug;114(2):97-109.
[2] Int J Mol Sci. 2023 May 23;24(11):9144.
[3] 美国癌症基因组图谱数据库(TCGA)
[4] 中国人群脑胶质瘤基因图谱数据库(CGGA)
[5] Cancer Res. 2011 Jun 15;71(12):4055-60.
[6] Br J Cancer. 2014 May 13;110(10):2560-8.
[7] npj Precision Oncology (2023) 7:47
