✦
•

研究背景
Background
生物样本库和医疗中心存有大量存档肿瘤组织,这些组织对理解疾病和开发疗法非常重要。为保存细胞形态和防止蛋白质降解,存档组织通常进行化学固定,细胞固定是临床病理学和生物医学研究的关键部分。
然而,现有分析技术如免疫组织化学、免疫细胞化学、流式细胞术和质谱等存在各种不足,例如免疫组织化学和免疫细胞化学只能报告蛋白质目标的存在、定位和分布;流式细胞术需要大量细胞且检测特异性有限;质谱在单细胞检测方面存在困难且不适用于所有蛋白质相关问题;平板凝胶免疫印迹虽然是一种靶向蛋白质组学方法,但传统的开放微流控芯片设计不适用于固定细胞的制备。
微流控技术在固定细胞的样本制备中具有优势,基于液滴和反应室的微流控系统可为细胞孵育、裂解和抗原提取提供封闭环境,有助于分析不同类型的细胞和多种固定条件。
在分析生物样本库中存档的样本时,需要在提高检测灵敏度和特异性的同时,减少对稀缺样本的消耗,这正是该研究的需求所在。

研究目的
Objectives
引入一种用于化学固定单细胞蛋白质组分析的混合微流控平台DropBlot,以解决现有单细胞分辨率蛋白质组分析工具在特异性和灵敏度方面的不足,同时节约珍贵的存档生物样本。
提供适合蛋白质亚型和蛋白质复合物分析的靶特异性,以解决许多这类蛋白质靶点缺乏特定抗体探针的问题。
利用DropBlot分析患者来源的肿瘤细胞样本,深入了解肿瘤细胞中蛋白质表达的异质性,为癌症研究和治疗提供新的见解和方法。
研究要点✦
•
研究过程
一.工作原理概述及步骤
DropBlot是一种用于化学固定单细胞蛋白质组分析的混合微流控平台,通过微流体H - 型连接点产生水包油(W/O)液滴,将单个固定细胞与含有表面活性剂的抗原提取缓冲液共封装在液滴中。
DropBlot通过 液滴技术实现了对 单个固定细胞的抗原提取,然后通过 开放流体芯片进行单细胞PAGE和免疫印迹,从而实现了对 化学固定单细胞蛋白质组的分析。

图1 DropBlot的设计、操作和鉴定
二.设计液滴及优化
在选择W/O化学物质和液滴生成条件时,需要考虑多种因素,以确保液滴能够在苛刻的抗原提取条件下保持稳定,同时实现足够的抗原溶解和最小化的抗原泄漏。
优化后确定了稳定的的液滴配方后是将 固定细胞在液滴中于98°C下孵育60 - 120分钟,以实现 抗原提取。
在监测期间荧光强度没有显著下降,背景强度几乎 保持恒定,并且单个液滴的强度分布在实验前后没有显著差异,这表明 该液滴配方能够有效地保存目标蛋白质。
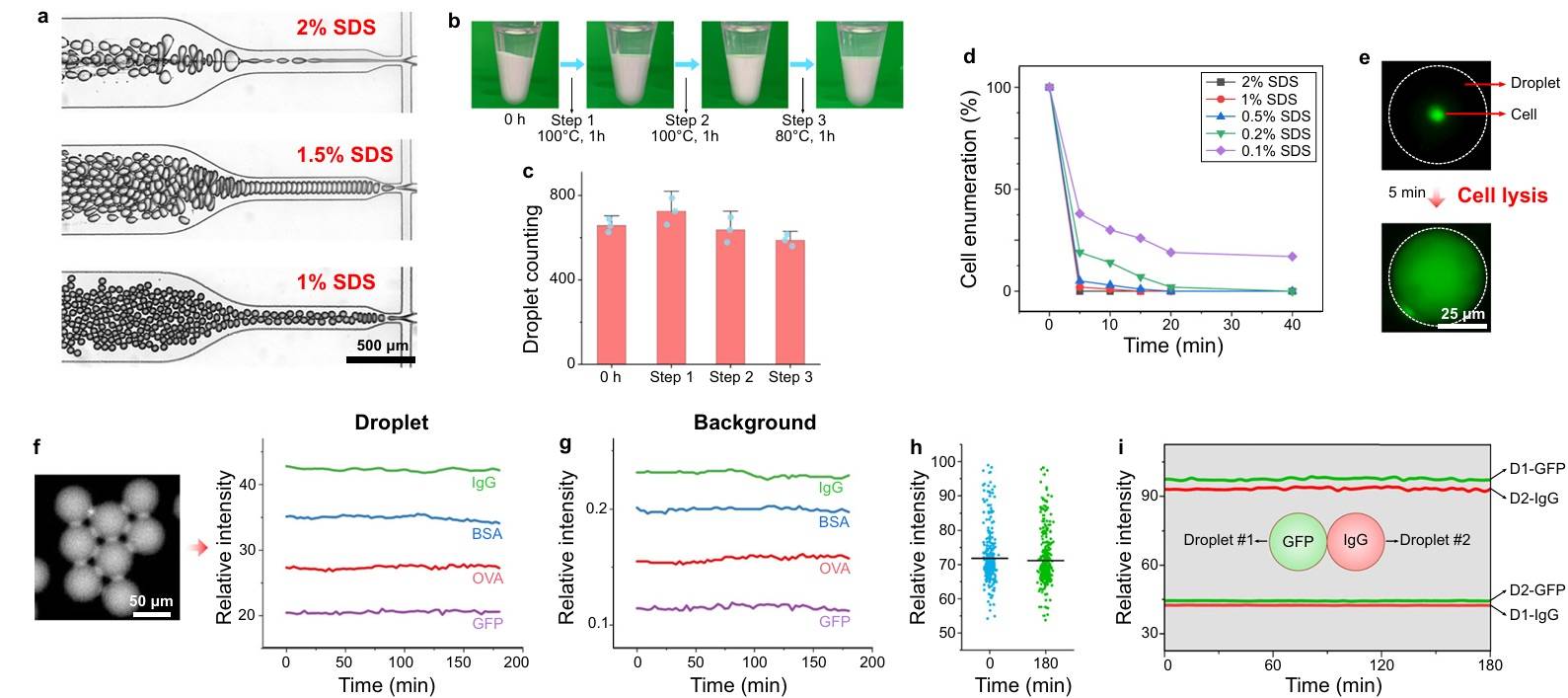
图2 设计和产生固定细胞裂解和抗原提取所需的稳定液滴,将液滴装入各个微孔以电转移到裂解的PAGE。

图3 蛋白质靶向电转移从微孔封装的W/0液滴到邻接的PAGE凝胶的模拟和验证
将含有细胞裂解物的液滴沉降到开放流体芯片的微阱阵列中,然后通过电转移将溶解的蛋白质目标从每个微阱封装的液滴注入到邻近的聚丙烯酰胺凝胶中,进行蛋白质分离。
在电转移过程中,通过数值模拟和实验验证了蛋白质从液滴到凝胶的注射效率和分散情况。
在合适的条件下,蛋白质能够从液滴中成功电转移到凝胶中,并在PAGE过程中实现有效的迁移和分离。
完成PAGE后,通过光捕获将蛋白质固定在凝胶中,然后进行免疫印迹和荧光成像检测。使用特定的抗体探针与蛋白质目标结合,通过荧光信号检测蛋白质的表达情况。
通过对不同细胞系和蛋白质目标的分析,验证了DropBlot在单细胞蛋白质组分析中的有效性和特异性。

图4 使用纯化蛋白标准品进行DropBlot分析
三.检测未固定癌细胞样本
测试DropBlot的样本制备和整合功能,评估抗原 - 检索缓冲液(包括SDS)与检索抗原的免疫反应性之间的关系。
DropBlot系统适用于分析未固定单细胞的蛋白质目标,能够区分不同细胞系中基于独特指纹蛋白质和蛋白亚型的差异。

图5 利用两个未固定的乳腺癌细胞系 MCF7和MDA-MB-231的单细胞进行 DropBlot分析
四.测试固定的癌细胞样本
1.PFA固定的癌细胞
通过DropBlot技术,从PFA固定的癌细胞系 (MCF7和MDA - MB - 231)中成功检测到蛋白质目标。 与新鲜癌细胞系相比,从PFA固定细胞中提取的蛋白质目标在PAGE中的 电泳迁移速度约慢50% ,这是因为PFA固定形成的新共价分子键使蛋白质的斯托克斯半径增大,电泳迁移率降低。 增加PFA固定时间(从15分钟增加到30分钟)和抗原检索孵育时间(增加到120分钟 )会显著减少可检测到的蛋白质峰的数量和强度。
2. 甲醇固定的癌细胞:
EpCAM检测 :使用DropBlot对甲醇固定的MCF7细胞进分析,虽然 EpCAM可被检测到,但电泳迁移速度比PFA固定的细胞更慢 。
蛋白质聚集 :观察到蛋白质信号在微阱附近升高,存在 大蛋白质二聚体分子或蛋白质聚 集 。
蛋白亚型分析:通过比较MCF7和MDA - MB - 231细胞中EpCAM和VIM的蛋白亚型分布。
电转移效率:PFA固定细胞中蛋白质目标的电转移效率范围为73.2%至84.8%,甲醇固定细胞中为44.4%至49.3%。
综上所述,DropBlot适用于分析PFA和甲醇固定细胞中的蛋白质目标,但对于甲醇固定细胞中不溶性蛋白质目标的减少,可能需要进一步优化。
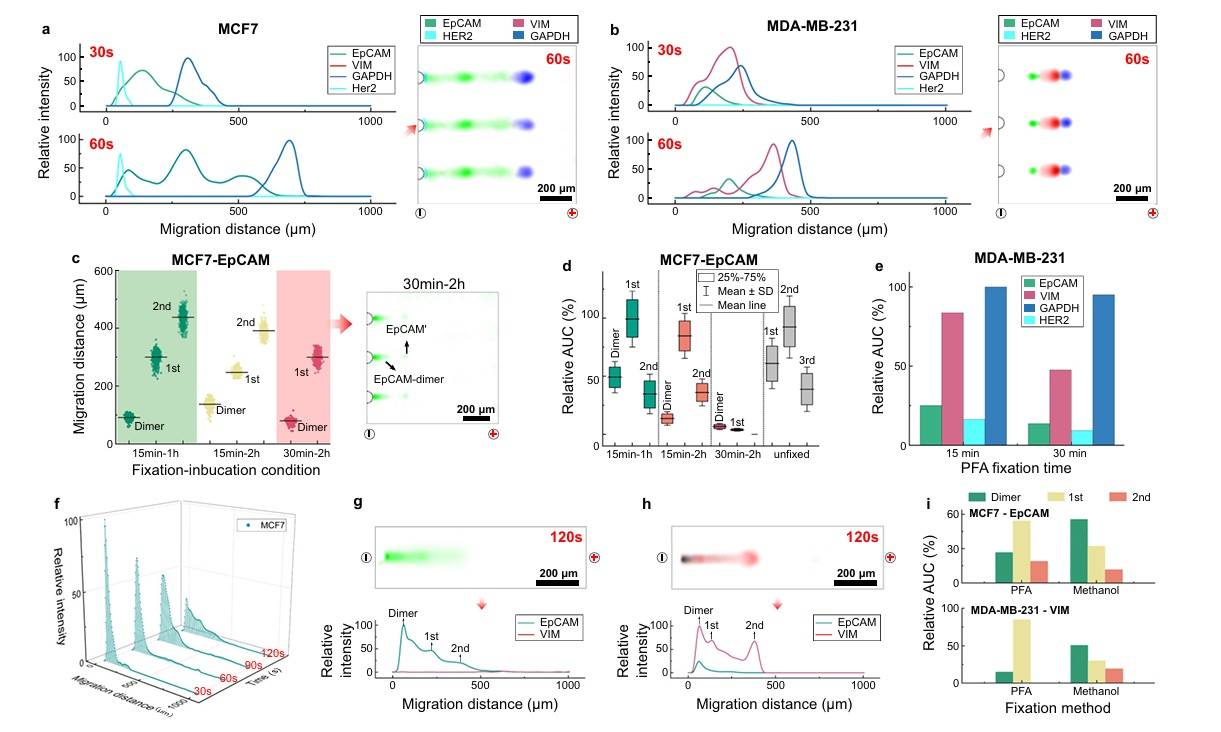
图6 使用单个PFA和甲醇固定的癌细胞进行DropBlot分析
研究亮点✦
•
DropBlot的技术优势包括以下几点:
1. 适用于固定细胞分析:能够对化学固定的单细胞进行蛋白质组分析,解决了传统开放微流控芯片设计不适用于固定细胞制备的问题。
2. 特异性适合蛋白质亚型和复合物分析:提供了适合蛋白质亚型和蛋白质复合物的靶特异性,且许多这类蛋白质靶点缺乏特定的抗体探针。
3. 节约珍贵的存档生物样本:采用微流控设计,相比于平板凝胶测定形式,能够减少对稀缺的存档固定生物样本的消耗。
4. 能够分析蛋白质亚型:可以分辨不同细胞类型基于其独特指纹蛋白质和蛋白质亚型的差异,例如在分析乳腺癌细胞系时,能够区分上皮细胞系和间充质细胞系中蛋白质的表达差异。
5. 检测细胞亚群:通过“细胞门控”模式,能够分析特定细胞亚群中蛋白质亚型的表达情况,如同流式细胞术一样,但在分析蛋白质亚型方面具有独特优势,是流式细胞术或其他现有单细胞免疫测定无法实现的。
6. 潜在的扩展性:可整合已建立的样本制备技术以检测稀有细胞,扩大目标检测多路复用,以及改进从FFPE细胞样本中进行抗原检索等。
研究结论✦
•
DropBlot 可以为珍贵生物样本库的单细胞分辨率蛋白质生物标志物挖掘提供精确的集成工作流程。DropBlot能够从PFA和甲醇固定的细胞中分析蛋白质,具有检测生物样本中有限细胞和蛋白质亚型的潜力,但仍需要进一步优化和改进。
参考文献
[1] Liu Y, Herr AE. DropBlot: single-cell western blotting of chemically fixed cancer cells. bioRxiv [Preprint]. 2023 Sep 6:2023.09.04.556277. doi: 10.1101/2023.09.04.556277. PMID: 37732260; PMCID: PMC10508777.
END
文案 | 赵梦溪
排版 | 赵梦溪
审核 | 赵梦溪
发布|姜笑南
世界生命科学大会
RECRUIT
关注我们,获取生命科学
学界前沿|促进更多的学术交流与合作
业界前沿|促进更快的产品创新与应用
政策前沿|促进更好的治理实践与发展
