大家好,今天我们来了解一篇关于超分子水凝胶的文章——《Using Chemistry To Recreate the Complexity of the Extracellular Matrix: Guidelines for Supramolecular Hydrogel–Cell Interactions》发表于《Journal of the American Chemical Society》期刊上。细胞外基质对细胞行为起着至关重要的作用,而模拟其复杂性是个巨大挑战。该文章介绍了超分子水凝胶在再生医学中作为 ECM 模拟物的潜力,通过聚焦两种超分子水凝胶系统,阐述了其设计原则和与细胞相互作用的指南。这对理解细胞-材料相互作用、开发新型生物材料具有重要意义,让我们一起来深入了解吧。
*本文只作阅读笔记分享*

一、引言
化学的一个重大挑战是用简单的方法重现自然的复杂性,例如细胞外基质(ECM)。ECM 是一个复杂的生物大分子系统,为细胞提供环境并调节其行为。模拟ECM的结构、机械、生化和动态特性对许多生物医学应用至关重要,如再生医学、可穿戴电子设备等。然而,重建ECM是一个巨大的挑战,需要化学家解开自然的秘密,用简化的方式重建其复杂性。

二、ECM 的重要特性
(一)物理和动态环境
ECM 是细胞所在的多组分动态网络,由蛋白聚糖(由糖胺聚糖形成)和纤维蛋白(如胶原蛋白)等大分子组成。它具有弹性和粘性,能与细胞进行物理、非共价相互作用,并提供化学信号。

(二)机械性能
组织的硬度差异很大,例如肺部的硬度约为1.9 kPa,而皮质骨的硬度可达20 GPa。此外,ECM具有特定的松弛机制和应力硬化特性,在施加应力时刚度会增加,这也会影响细胞行为。ECM本身是一个高度动态的多组分网络,主要通过非共价相互作用维系。

(三)生物活性
ECM的生化信息对细胞行为有很大影响。整合素受体是调节许多ECM-细胞相互作用的重要受体,它与细胞外的ECM糖蛋白(如层粘连蛋白、胶原蛋白和纤连蛋白)结合,并将信息传递到细胞内,从而调节许多细胞-ECM相互作用。

(四)细胞-材料通信
ECM与细胞相互作用是双向的,细胞影响和重塑基质,基质引导细胞行为。这种高度动态、响应性和重塑的关系对于许多细胞功能至关重要,理解这种通信对于设计和合成能与生物系统相互作用的功能材料至关重要。

三、当前先进的水凝胶作为 ECM 模拟物
(一)水凝胶分类
当前的ECM模拟材料包括天然、混合、合成共价和(合成)超分子水凝胶。传统水凝胶设计基于静态、共价交联的水凝胶,缺乏ECM的动态性质。而基于物理、非共价或可逆共价化学的交联水凝胶能赋予水凝胶动态、粘弹性特性。
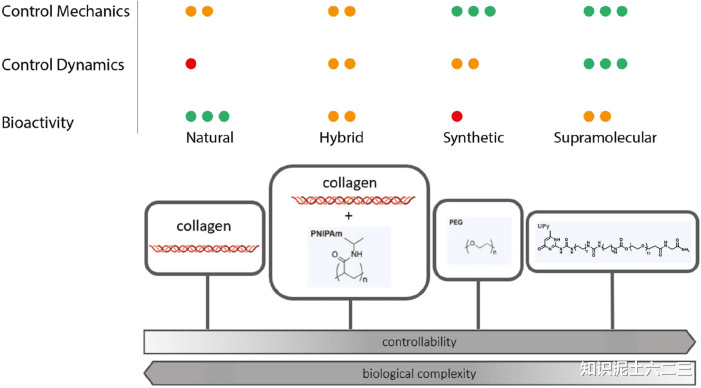
(二)超分子水凝胶的优势
超分子化学的发展为创建更接近自然系统的复杂性和动态性提供了更简单的途径。超分子水凝胶融合了水凝胶和超分子化学的独特优势,具有自愈合、按需可逆凝胶化、应力松弛和刺激响应等有趣特性。

四、通过超分子方法模拟ECM的复杂性
(一)超分子相互作用
超分子相互作用是可逆的非共价相互作用,可形成超分子组装体或更明确的超分子聚合物。因其内在的动态性、适应性和可调性,有望用于创建ECM模拟物。可通过将生物活性线索与单体构建块耦合并混合到超分子组装体中轻松引入生物活性功能,超分子共聚可用于调节配体呈现、纤维形态和机械性能,单个系统共同组装成更大的分级复合物可能是重现天然ECM所有重要特性的关键。

(二)基于超分子相互作用的生物材料
基于天然和工程组件的超分子相互作用
海藻酸盐:可通过二价阳离子(如钙或钡)方便地形成凝胶,但本身不可生物降解,在人体内的降解不可预测,且细胞粘附有限,需要功能化以促进蛋白质结合和细胞附着。

混合凝胶:如牛血清白蛋白(BSA)网络与非共价吸附的聚电解质增强,以及胶原蛋白和透明质酸(HA)的组合,这些混合凝胶能提供不同的性能,如增强和大的硬化效果、自我修复和形状记忆功能等。

弹性蛋白样蛋白(ELPs):可通过改变氨基酸或组装条件来精确调节其机械性能,并可利用 RGD 作为配体创建具有特定细胞粘附信号的材料。

重组蛋白:如 Tirrell 实验室开创的使用重组蛋白制造水凝胶,通过引入非经典氨基酸可对蛋白质的特定区域进行化学修饰。

基于肽两亲性分子(PAs)和肽的超分子聚合物
PAs的设计:由功能化的两亲性构建块与肽序列组成,包括疏水域、氢键区域、极性头基和可选的带电区域或功能单元,通过改变这些区域的设计可形成不同形状的两亲性分子,组装成不同的大结构。
常见的PA水凝胶:基于IKVAV等生物活性基序的 PAs 可形成纤维网络,如商业的 PuraMatrix 基于 RADA 序列形成稳定的 β-片层纳米纤维。

对PA结构的调制:近期对PA结构中动力学的调制研究显示了对这一难以捉摸的性质进行控制的强大潜力,如Mata实验室在理解多组分、基于PA的超分子水凝胶用于再生医学应用方面做出了重要贡献。

基于小单体构建块的超分子聚合物
Bola-两亲性分子:其核心由两个亲水端基屏蔽的疏水核心组成,可增加溶解度并设计各种形状和结构。
Sijbesma和Palmans的设计:基于互补双脲基序的材料,通过改变PEG的长度和脂肪族连接体的大小可调节机械性能和屈服应变,还可引入共价交联并展现出应力硬化行为,该超分子系统易于引入生物活性部分。

BTA-基超分子水凝胶
分子结构与形成:C3-对称的盘状分子BTA,通过修饰其核心为C12疏水间隔和四(乙二醇)(EG4)亲水链,可在水中形成双螺旋超分子聚合物,纤维的形成由π-π相互作用、三重分子间酰胺氢键和疏水效应驱动。
可调性质的水凝胶:通过将常规BTA与双功能的 BTA-PEG-BTA 混合,可形成具有不同机械刚度和动力学的水凝胶,且这些差异具有良好的生物相容性,可用于细胞封装。

UPy-基超分子水凝胶
分子结构与自组装:UPy分子通过自互补四重氢键在DDAA方式下形成二聚体,尿素或氨基甲酸酯基团允许横向生长。通过引入双功能的UPy - PEG - UPy可形成纤维网络,从而形成水凝胶。

机械和动态性能的调节:通过改变B-和M-型分子的比例或改变水凝胶的浓度,可以调节水凝胶的机械和动态性能。

细胞粘附的调节:细胞铺展可以通过改变M和B UPy的比例来调节,即通过改变水凝胶的应力松弛来实现。

五、超分子水凝胶-细胞相互作用指南
(一)水凝胶机械性能
细胞对机械刺激有反应,水凝胶的局部刚度反映了小长度尺度下单个纤维或纤维簇的机械性能,而整体刚度反映了整个水凝胶的平均刚度。在大多数情况下,测量和报告的是水凝胶的整体刚度,但细胞实际上在更小的长度尺度上感受水凝胶的刚度,这与焦点粘附(FA)的长度尺度重叠。

例如,通过原子力显微镜(AFM)对超分子UPy凝胶进行纳米压痕,测得局部刚度的杨氏模量(E)约为 10 kPa,但局部刚度不会随水凝胶整体刚度的改变而改变。然而,超分子凝胶中可能存在局部不均匀性,即纤维束区域。

对于不同的培养维度,水凝胶的整体刚度对细胞性能的影响不同。在2D中,软凝胶(200 Pa)上的应力松弛决定了细胞行为,在快速松弛的凝胶(τ1 / 2≈50 s)上,细胞牵引力被松弛,阻止细胞建立张力并阻碍细胞铺展,而在更硬的凝胶(> 1 kPa)上,应力松弛服从于刚度。在3D中,在软凝胶(200 Pa)中培养的细胞会形成细胞聚集,细胞-细胞相互作用占主导,而当提供约1 kPa的基本刚度时,细胞-基质相互作用占主导,为细胞提供足够的机械支持。进一步增加刚度可能会导致机械限制,阻碍组织生长。

(二)水凝胶生物活性性能
细胞可能对配体类型、浓度和呈现方式作出反应,这反映在配体间距、价态、模式和有效配体浓度上。
生物活性所需的类型取决于细胞目标,可分为细胞粘附序列和细胞信号基序。对于这两种细胞类型,最小的合成序列可作为其天然对应物的模拟物纳入水凝胶中。配体的类型需要与细胞上表达的感兴趣的受体类型相匹配,最常见和有效的细胞粘附线索是纤连蛋白衍生的RGD序列,靶向整合素α5β1和αVβ3。
通常在合成水凝胶中使用超生理配体浓度(如 1 mM 的最有效的生物活性UPys(UPy-cRGD))以实现细胞反应(如细胞铺展或正确的极性),这可能是由于立体障碍/配体向受体的低效取向导致的,部分生物活性超分子单体可能被“屏蔽”在成束的超分子纤维内部,降低了它们与生物实体结合的可用性。此外,配体呈现方式很重要,通过控制DNA实现对配体呈现的几何控制,多价配体可促进后续受体聚类,当有效配体浓度(Ceff)≥5 mol% 时可观察到多价效应。

(三)水凝胶动力学
超分子系统在不同长度尺度上表现出动态行为,分子动力学发生在纤维水平(单体在纤维内和纤维间的交换),而整体动力学发生在凝胶水平(凝胶中的应力松弛-纤维重排)。对于分子动力学影响细胞行为,UPy-基超分子纤维几乎没有单体交换(约10% 在1 h 内),而 BTA-基超分子纤维显示出更快的单体交换(约 30-40% 在1 h 内)。
重要的是,分子尺度上的分子动力学与宏观尺度上的整体动力学相关,UPy 凝胶表现出缓慢的应力松弛(τ1 / 2≈1000 s),而 BTA 凝胶表现出快速的应力松弛(τ1 / 2≈50 s)。在稳健的 UPy 超分子系统中观察到细胞铺展,而在更动态的 BTA 超分子系统中,细胞呈圆形形态。这表明稳健地将细胞粘附线索纳入超分子纤维对于实现细胞铺展至关重要,否则细胞会将生物活性单体从堆栈中拉出。
在 2D 中,软凝胶(约 200 Pa)上缓慢的应力松弛(τ1 / 2≈1000 s)对于实现细胞铺展至关重要,快速松弛的凝胶(τ1 / 2≈50 s)会使细胞牵引力松弛,阻碍细胞铺展。在3D中,快速松弛的凝胶(τ1 / 2≈50 s)通过消散组织力促进单细胞生长为多细胞类器官,而缓慢松弛的凝胶可能会导致机械限制,阻碍细胞铺展和组织生长。

六、结论
不同的细胞类型需要不同的环境来实现最佳的细胞性能,培养维度(2D 与 3D 培养)和细胞类型(单细胞与多细胞类器官)都很重要,因此设计生物材料以实现最佳细胞性能的标准应根据细胞类型进行定制。超分子工具箱允许根据细胞或特定 ECM 的精确需求定制材料属性。
七、未来展望
(一)材料方面
结合共价键和动态自组装:胶原蛋白是一个很好的例子,其性能不仅依赖于自组装,还依赖于重要的交联后组装(如醛醇缩合)。在许多生物组装中,共价和超分子相互作用的强大效果都可以观察到,未来的工作可以将这两种键合类型结合在先进的超分子结构中,以实现令人印象深刻的性能。
工程时空控制:包括引入生物活性信号梯度或局部控制配体浓度(通过微凝胶实现),以及使用光或酶敏感的刺激响应基团来控制凝胶的机械或生物活性性质随时间的变化。例如,Segura、Anseth 和 de Laporte 实验室使用微凝胶实现了对凝胶性质的局部控制。
结合筛选和人工智能:通过实验和建模相结合的方式,处理和评估大量不同材料组合对细胞结果的性能,如 Weil 实验室等已经开始利用数据挖掘策略、贝叶斯优化或实验设计方法来研究中间规模的数据集。
模拟自然 ECM 的能量密集型重塑和细胞响应:将细胞响应元素与非平衡组件结合到真正的耗散系统中是一个有吸引力的研究方向,尽管目前工程矩阵仅表现出基本的非平衡行为和细胞通信,但这是未来的一个重要发展方向。

(二)细胞方面
利用合成生物学:合成生物学的进展使得使用细胞作为化学工厂创建生物材料成为可能,将合成化学与合成生物学相结合,有望创造出具有生物复杂性和生产生物分子能力的材料,用于生物医学和可持续性的重大挑战。例如,Kietz 和 Rosales 实验室的合作展示了这种可能性。

操作细胞方面:包括抑制或增强细胞表面受体(如使用整合素激活或抑制抗体)、操纵细胞膜流动性(如使用甲基-β-环糊精(MCBD)或甘油等药物调节膜 “软化” 或 “硬化”)以及调节细胞下游信号通路(如使用 Rho-激酶(ROCK)抑制剂来研究细胞收缩系统在细胞 -材料相互作用中的作用)。此外,还可以通过基因修饰使细胞特异性地与目标相互作用,如通过基因靶向化学组装(GTCA)在特定基因修饰的细胞上原位附着功能材料,或通过调节受体表达来实现对免疫治疗的更好控制和精度。
(三)创新应用
未来的工作可利用这些指南推进再生医学、生物电子学和免疫工程等领域的发展,为创新应用开辟新的可能性。例如,在再生医学领域,这些指南可用于培养更复杂的活体组织;在生物电子学领域,可改善当前导电材料的保留和细胞类型特异性;在免疫工程领域,可实现局部免疫调节,提高免疫细胞治疗的效率和靶向精度。

参考文献:
Rijns L, et al. Using Chemistry To Recreate the Complexity of the Extracellular Matrix: Guidelines for Supramolecular Hydrogel-Cell Interactions. J Am Chem Soc. 2024 Jul 3;146(26):17539-17558.
