FDA于9月13日发布了826篇计划修订的具体产品指南(PSG)清单,以取消餐后生物等效性研究的要求,
该指南将于 2025年1月1日生效。
抗流感病毒新药——巴洛沙韦玛波西酯
【药品名称】玛巴洛沙韦
【剂型】 片剂【规格】10mg;20mg;40mg
【分类】 化药4类
【其他剂型】
2020年11月,巴洛沙韦口服混悬液(2mg/mL)获得美国FDA批准上市。
【适应症】本品适用于 12 周岁及以上单纯性甲型和乙型流感患者,包括既往健康的患者以及存在流感并发症高风险的患者。
【用法用量】
在症状出现后48小时内单次服用即可,可与或不与食物同服。全程只需口服给药1次,可显著提高患者特别是儿童患者的用药依从性。
给药剂量与患者体重有关:体重在20-80公斤的患者,推荐服用40mg的剂量;体重在80公斤及以上,推荐服用80mg(40mg✖2片或20mg✖4片)的剂量。【上市信息】巴洛沙韦玛波西酯是近20年来首创的新作用机制的抗流行性感冒(流感)病毒新药,由日本盐野义制药株式会社首先研制,作用于流感病毒基因组转录所必需的聚合酶酸性蛋白的内切酶,对甲型和乙型流感病毒均有很强的抑制活性。
日本厚生省新药审批部门:日本医药品医疗器械综合机构于2015年11月给予该公司单剂治疗≥12岁、无并发症的急性流感优先评审待遇,2018年2月予以加速许可,用于治疗甲型和乙型流感,并于2018年2月23日批准上市。
2016年2月盐野义制药公司与瑞士罗氏制药公司签署合作协议,授予罗氏公司除日本和中国台湾地区之外的全球开发与经营权,只保留在美国共同开发权。瑞士罗氏制药集团公司属下的基因泰克(Genentech)制药公司于2018年6月26日获得FDA优先审评资格,并于2018年10月24日获准上市。
2021年4月,巴沙洛韦在国内获批上市,同年12月被纳入医保药品目录。
仿制药国内一家在报。
【优势】
巴洛沙韦不同于靶向神经氨酸酶的抗流感药,它是通过抑制流感病毒的CAP-依赖型核酸内切酶来抑制病毒复制,在流感自我繁殖的早期发挥药效,阻断流感的速度比神经氨酸梅抑制剂更快。相较于奥司他韦,巴洛沙韦的半衰期较长,t1/2约为90小时,因此巴洛沙韦服用一次可持续4-5天有效,单次给药优于奥司他韦的每日两次给药,患者用药依从性将显著提升,因此巴洛沙韦有望延续甚至超越奥司他韦的销售盛况。巴洛沙韦也是全球少数可以抑制流感病毒增殖的新药。
【参比制剂】
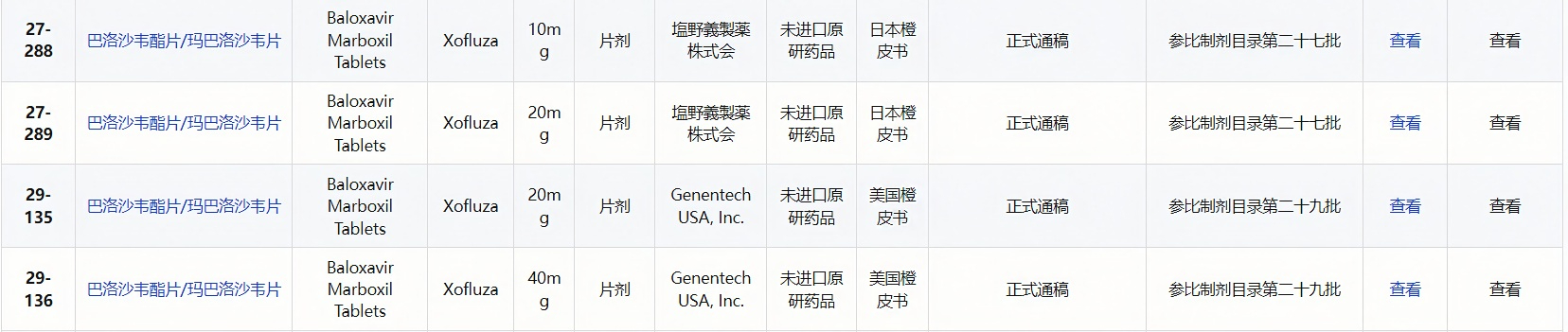

【原料供应】
原料国内两家企业备案,状态均为A。
【专利】
化合物专利到期时间2031年9月21日
【售价】
据公开数据查询显示,巴洛沙韦在国外定价颇高,10 mg/10 片/盒规格的价格达 400 美元,国内20mg*2片/盒售价498元。
【凯瑞德研发进度】小试进行中。
