10月16日,国际高影响杂志《TheAmericanJournalofHumanGenetics》在线发表了首都儿科研究所遗传学研究室陈晓丽研究员课题组最新研究成果“MARK2variantscauseautismspectrumdisorderviathedownregulationofWNT/β-cateninsignalingpathway”。
孤独症谱系障碍(Autismspectrumdisorder,ASD)也称自闭症,是一种以社交障碍、兴趣狭窄和重复刻板行为为特征的神经发育障碍。ASD作为儿科的常见疾患,也是世界范围内影响儿童健康的最严重公共问题之一,影响着全世界0.7-1.69%的儿童。目前ASD尚无特效治疗手段及药物。主要依靠早期干预治疗改善患者的预后,严重影响儿童社会功能和生活质量,从而影响中国未来人口素质。
从基因组角度考虑,儿童ASD是一组具有高度基因型/表型异质性的疾患,5%-30%的受累个体具有孟德尔疾病。随着基因组技术的进步,对自闭症队列进行的大规模测序研究已确定了300多个ASD风险基因,其中包括100个高可信度基因。大多数与ASD相关的基因对人类基因组中的功能缺失(LoF)突变高度不耐受,提示这些基因突变后蛋白功能丧失是单基因ASD发病的遗传致病模型。即使通过大队列测序研究发现了很多ASD的新基因,但这些新基因导致ASD发生的分子基础和病理改变都尚未破解,所以需要寻找合适的疾病模型,开展ASD的脑机制研究,寻找受累靶分子/通路并探索潜在的治疗靶点。
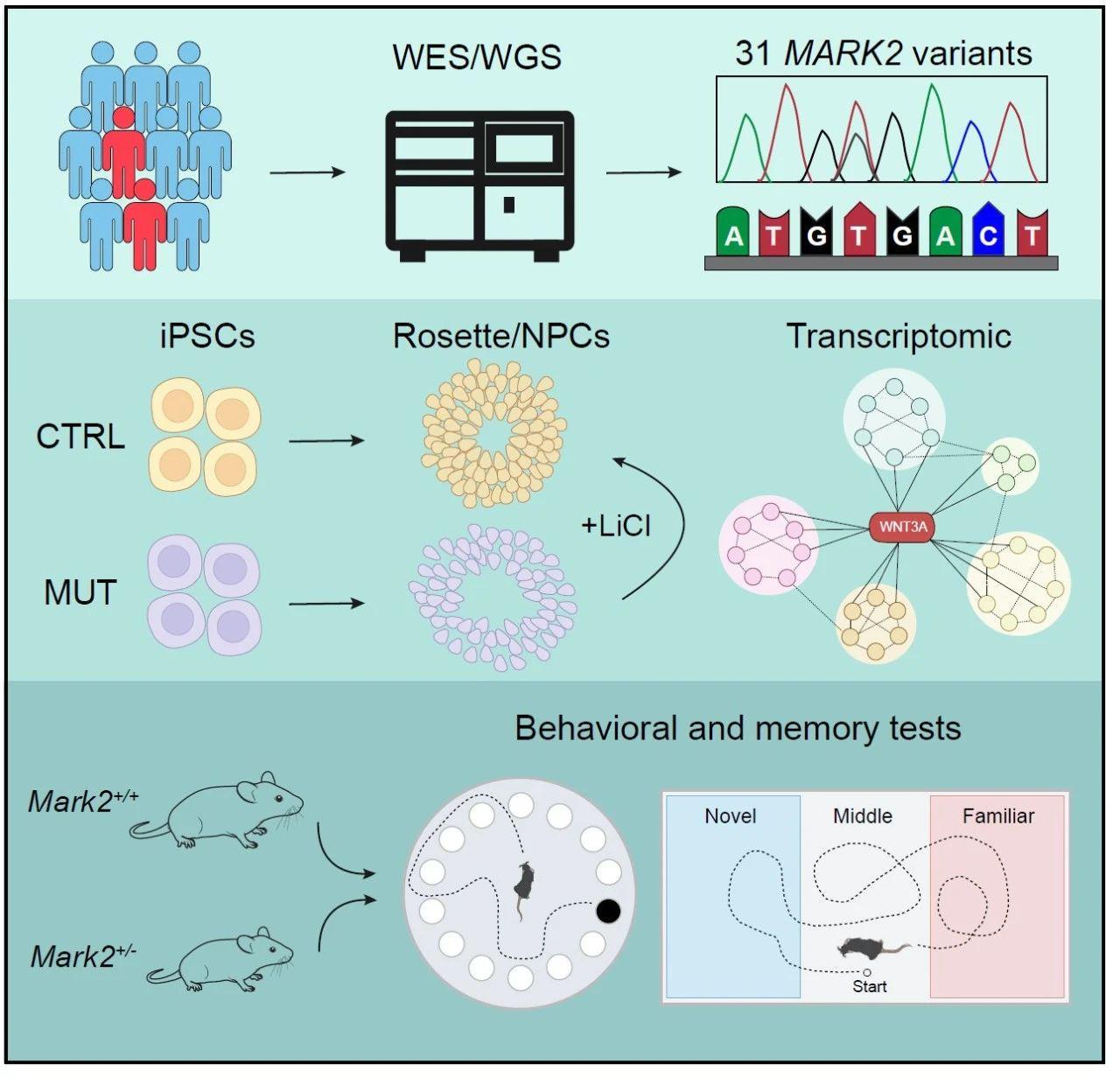
课题组利用GeneMatcher数据共享平台进行全球招募,和10个不同国家的24家医院/机构合作,建立MARK2基因突变的国际合作联盟,共招募到31例携带MARK2突变携带者。所有受累者均存在ASD及其他神经发育障碍特征,且多数具有特定面容,功能缺失突变体在受累个体中占多数(81%);为了明确MARK2突变后皮层神经细胞的发育表型组学特点,研究者利用患者来源的诱导多能干细胞结合CRISPR基因编辑技术将iPSCs模型定向分化为神经小球、神经花环和皮层神经细胞等。结果显示MARK2突变会导致早期神经细胞发育和功能缺陷,包括iPSCs衍生的神经花环呈现异常极性,以及iPSC衍生的神经前体细胞发生不平衡增殖和分化等;此外,在Mark2+/-(HET)小鼠中,研究者重现了在突变NPCs中观察到的病理生理缺陷,小鼠表现出异常的皮质形成和分区以及受影响个体表现出ASD相关行为;接下来的转录组学数据显示,MARK2突变导致WNT/β-catenin信号通路抑制,多个WNT分子的mRNA表达水平显著下调,而β-catenin在mRNA和蛋白水平都显著下调。由此,研究者将MARK2缺失与下调的WNT/β-catenin信号通路联系起来,揭示了WNT/β-catenin信号通路的下调是MARK2变异的分子机制,并且发现临床治疗剂量LiCl可以通过重新激活WNT/β-catenin信号通路在体外和体内逆转突变NPCs的异常细胞表型,确定了LiCl是可能作为治疗MARK2相关ASD的潜在药物。该项目将解决儿童ASD背后的核心科学问题,促使基础研究走向应用。
该项目获得国家自然基金面上项目(2371868,82271428,31900690,82201314),北京市自然基金项目(7202019),北京市财政项目(CIP2024-0040)资助。
中国科学院动物所刘长梅研究员团队的博士后公茂磊、首都儿科研究所陈晓丽研究员团队的博士研究生李佳一、广西壮族自治区妇幼保健院医生覃在龙和梅奥研究所的MatheusVernetMachadoBressanWilke为本文共同第一作者。梅奥实验室合作者完成MARK2错义突变的预测和3D模型构建,对MARK2关键结构域的错义突变体对结构域酶活性和蛋白稳定性进行预测。首都儿科研究所陈晓丽研究员和中科院动物所刘长梅研究员为共同通讯作者。

陈晓丽研究员课题组长期关注包括孤独症谱系障碍在内儿童神经发育障碍的遗传研究。通过该项目,课题组成员获得开展孤独症国际合作研究的经验和信心,科研工作也获得国际同行认可和信任。该工作为课题组今后开展其他孤独症相关罕见病国际队列研究打下基础。
