肥胖与糖尿病的关系十分密切,在2型糖尿病成人患者中,90%属于超重或肥胖人士。有模型预测,到2030年,将有9.5%的成年人患有糖尿病,其中三分之一的增长可以直接归因于肥胖。
在饮食导致肥胖的过程中,身体会迅速发展“胰岛素抵抗”(insulinresistance)的病症,也就是通常说的糖尿病前期。胰岛素是胰腺分泌的激素,作用是指挥细胞摄取葡萄糖分子并将其转化为能量。但在胰岛素抵抗的情况下,细胞对胰岛素没有反应,不摄取糖分子,导致进入血液的葡萄糖超标。时间久了,胰腺不断试图加大胰岛素的分泌量,最终崩溃,而血糖水平则不断升高,到达糖尿病的诊断标准。
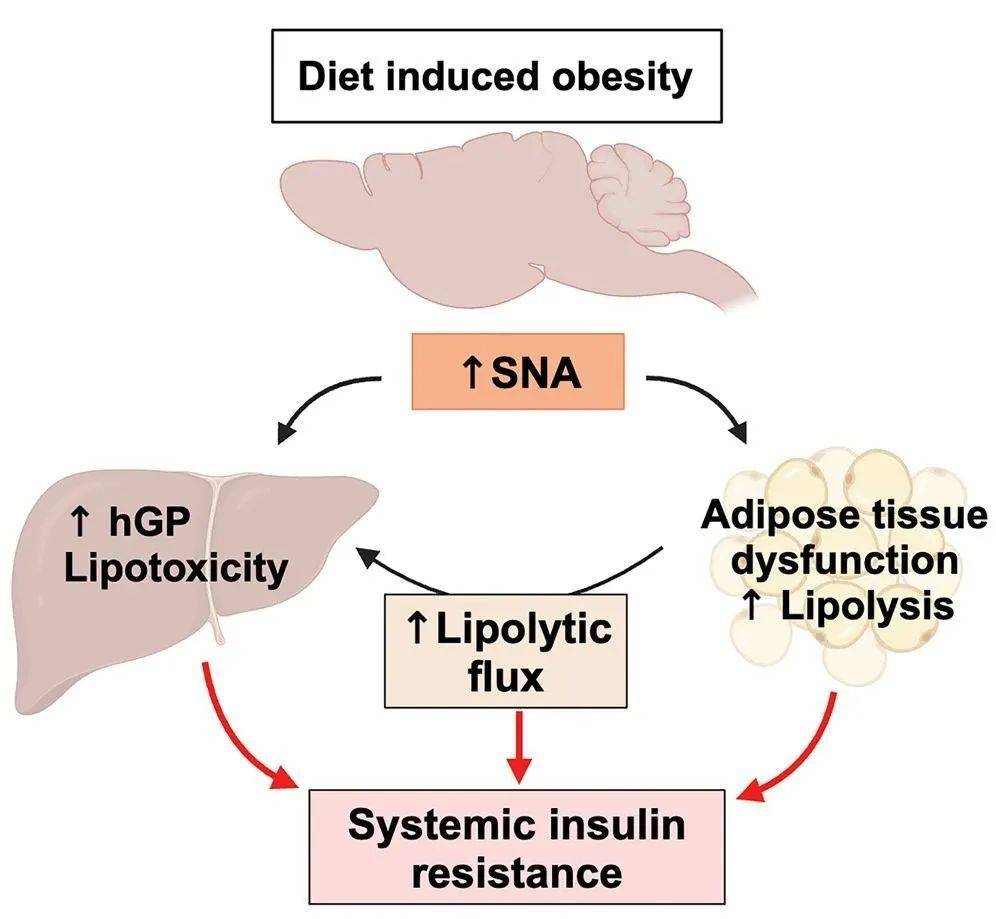
在以往的认识中,肥胖之所以会引起胰岛素抵抗,是因为在肝脏和脂肪组织中,细胞的胰岛素信号传导受损,无法控制脂肪的分解,导致脂肪酸过量释放。然而,日前发表在《细胞-代谢》上的一篇研究论文提出了不同的机制。

美国罗格斯大学的生理学家ChristophBuettner教授长期关注糖尿病和胰岛素抵抗问题,他和同事们发现,在容易导致肥胖的高脂肪饮食条件下,交感神经系统会被过度激活,导致去甲肾上腺素(NE)等神经递质大量输送到肝脏等组织,触发脂肪大量分解,而这一过程与细胞胰岛素信号无关。
这一新发现对于我们认识饮食、肥胖与糖尿病的关系相当重要。因为过去一度以为肥胖驱动糖尿病的主要问题出在控制脂肪细胞的刹车(胰岛素)失灵,而新研究的结果却告诉我们,其实是油门踩得太用力了,而加大踩油门力度的就是大吃大喝导致的营养过剩。
交感神经系统是脑控制内脏器官功能的神经系统分支之一,神经细胞主要通过去甲肾上腺素传递信号,也会释放肾上腺素。在这项新研究中,为了准确地评估营养过剩对交感神经系统活性的影响,研究人员使用了他们开发的一种小鼠模型。在这些小鼠的内脏器官和四肢中,有一个基因被删除了,这个基因负责编码的酶(酪氨酸羟化酶)是产生去甲肾上腺素、肾上腺素等儿茶酚胺类神经递质的关键酶,因此可以减少交感神经系统激活时释放的信号,同时小鼠的中枢神经系统不受影响。
随后,研究人员给小鼠提供了富含猪油、椰子油、大豆油的高脂肪饮食。相比常规鼠粮,这些香喷喷的高脂肪饮食很容易让小鼠长胖,基因正常的野生型小鼠吃上3~10天就会表现出体脂增加、血糖水平升高,往往2周以后就会出现胰岛素抵抗。然而,那些基因缺失的小鼠,同样吃着高脂肪食物,却没有出现胰岛素抵抗,空腹血糖水平保持正常,尽管它们也同样因为吃多了而体重增加。
从这些小鼠的验血结果可以观察到,野生型小鼠在短期营养过剩时就迅速升高了血浆的去甲肾上腺素水平,表明交感神经系统活性过高;同时血浆甘油水平升高,说明白色脂肪组织的脂肪分解增加。相比之下,基因缺失的小鼠,其外周组织中的去甲肾上腺素水平要低90%,血浆甘油水平降低。与此同时,两组小鼠细胞的胰岛素信号活性相似,说明胰岛素敏感性的差异与细胞胰岛素信号通路无关。
当研究人员继续用高脂肪饮食喂养小鼠,经过3~4个月,长期营养过剩让野生型小鼠不仅胰岛素抵抗,还表现出了脂肪肝和组织炎症增加的迹象;而基因缺失小鼠在外周交感神经系统活性受限的情况下,虽然是吃胖了,却始终没有受到胰岛素抵抗、脂肪组织功能障碍、肝脂肪变性等健康问题的影响。
基于这些发现,研究人员提出,交感神经系统活性激增导致脂肪组织的脂肪分解增加,是营养过剩吃出代谢疾病的主要原因。这意味着,从降低交感神经系统活性入手,或可找出防止高脂肪饮食引起胰岛素抵抗的方法。至于高脂肪饮食究竟如何触发去甲肾上腺素等神经递质的激增,研究人员也将继续探索。
参考资料:[1]KenichiSakamotoetal.,Overnutritioncausesinsulinresistanceandmetabolicdisorderthroughincreasedsympatheticnervoussystemactivity.CellMetabolism(2024)Doi:https://doi.org/10.1016/j.cmet.2024.09.012
