转自:新康界
正当市场为百济神州的BTK抑制剂泽布替尼2024年销售额同比大增106.4%而热议时,来自MNC巨头诺华的另一款BTK抑制剂瑞米布替尼片(remibrutinib)也悄然递交了国内上市申请。
但与目前已上市的多款同靶点药物不同的是,诺华该款药物并未加入血液瘤领域的BTK抑制剂大军,而是选择自免领域,并瞄准了竞争格局尚被认为是“小而美”的过敏药赛道。
这也是自免适应症的BTK抑制剂中,进度最快的一款药物。
20年前推动IgE抗体药物奥马珠单抗进入中国过敏药市场捞金后,诺华如今再度抛出BTK抑制剂,无疑是冀望利用差异化的布局争取更多的突围机会。
但奥马珠单抗中国专利早在2016年已到期,越来越多仿制药已在来的路上,在目前规模已接近600亿元的国内过敏药市场,这款新来的BTK抑制剂能否重新复刻奥马珠单抗的成功路径,甚至与抗组胺药物PK?
01
BTK抑制剂杀入过敏药市场
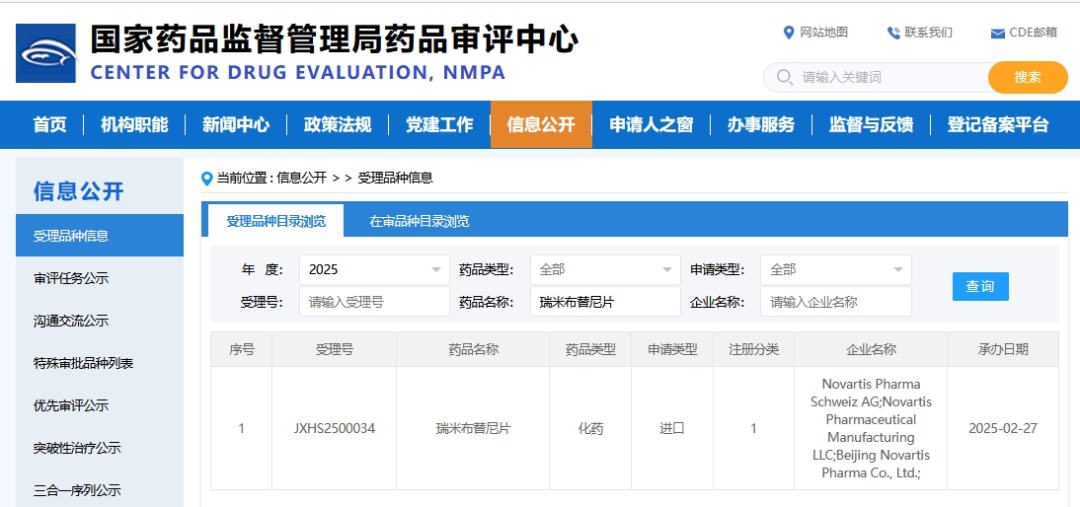
据中国国家药监局药品审评中心(CDE)官网的公示,诺华的1类新药瑞米布替尼片(remibrutinib)于2月27日获受理上市申请,也是全球首次申报上市。
该药物属于一种高度选择性的布鲁顿酪氨酸激酶(BTK)抑制剂,2024年5月宣布完成关键Ⅲ期研究,并在治疗慢性自发性荨麻疹(CSU)的过程中表现出持续52周(一年)的显著症状改善,计划在同年底开始递交上市申请。
因此本次瑞米布替尼片在中国申报上市,外界推测首发适应症大概率是刚到达临床研究终点的慢性自发性荨麻疹。
在此之前,BTK抑制剂的研发方向更多在于血液肿瘤领域,且诞生了不少全球明星大单品,例如强生/艾伯维的伊布替尼、阿斯利康的阿可替尼,还有一直备受关注且业绩增长迅猛的国产代表百济神州的泽布替尼。
新康界了解到,瑞米布替尼片是全球首个在自免领域成功完成III期临床的BTK抑制剂,也因此被诺华视为下一代自免重磅产品。
但在此之前,赛诺菲旗下的同款口服共价BTK抑制剂rilzabrutinib片其实已在2024年12月底率先获得CDE受理上市申请,不过适应症为免疫性血小板减少症(ITP),与诺华切入的慢性自发性荨麻疹等过敏药物市场有所错开。
瑞米布替尼片也是BTK抑制剂中首度覆盖过敏类适应症的药物,目前该药还有多项在研的适应症,包括化脓性汗腺炎、食物过敏、慢性诱导性荨麻疹和多发性硬化等。
从规模来看,诺华选择过敏药物市场作为瑞米布替尼片的上市首站,无疑是看中这一赛道巨大的潜在市场容量提升空间。
过去数十年间,过敏性疾病的发病率呈快速增加的趋势,影响着全球10-40%的人口,已被世界卫生组织列为21世纪需重点防治的三大疾病之一,常见的病症有荨麻疹、过敏性鼻炎、过敏性哮喘、特应性皮炎、食物过敏等。
《2022中国过敏性疾病流行病学调查报告与现状分析》显示,仅荨麻疹一类,中国就约有2.6%也即约3600万人成人曾经或正在遭受其困扰,平均每20到200人,就有一位荨麻疹患者。
放大至整个过敏性疾病领域,2023年中国过敏性疾病的就诊患者数量达2678万人,人均当年费用里治疗费用占73%,存在过敏症状的患者数量更是高达4亿以上。
庞大的过敏患者人群背后,是持续增长的临床需求和市场增长潜力。
弗若斯特沙利文预计,2024年球全抗过敏药物的市场总规模将达到630亿美元(约合人民币4598亿元),其中中国市场规模将达到82亿美元(约合人民币598亿元)。
头豹研究院根据过去五年的行业规模增长情况测算,预计2028年国内过敏性疾病行业市场规模将增至778.7亿元。
更重要的是,现有临床常用过敏药二代抗组胺药物还存在超两成患者无效,以及嗜睡、乏力、胃肠道不适等副作用较严重的亟待改善问题;糖皮质激素同样可能引发骨质疏松、高血压、糖尿病等系列副作用,更优的新药需求渴求强烈。
面对未来几年规模可增长至近800亿元的市场蛋糕,诺华不是第一个抢食者,显然也不会是最后一个。
02
小而美的蓝海市场?
目前国内获批上市的过敏性疾病治疗用的生物制药并不多,包括奥马珠单抗(靶向IgE),美泊利珠单抗(靶向IL-5)、度普利尤单抗(靶向IL-4)、贝拿利珠单抗(靶向IL-5R)、特折鲁单抗(TSLP)等。
而过敏性疾病的主要发病机制,与一种特异性免疫球蛋白IgE((ImmunoglobulinE)有关,当人体内出现过敏反应时,IgE就会增高。因此靶向IgE的抗体药物,是目前开发过敏新药或新疗法的重要方向。
2003年已经美国FDA批准上市,并在2017年进入中国市场的奥马珠单抗(Omalizumab),是目前IgE抗体药物的代表,适应症包括哮喘、荨麻疹等。
因2019年顺利进入医保目录,且覆盖了6岁以上的患者,可降低哮喘严重恶化率等优势,奥马珠单抗成为目前过敏性哮喘患者使用较多的生物制剂之一,使用占比高达78%。
该药同样由诺华/罗氏共同开发,上市逾20年后,2024年销售额依然高达43.43亿美元,同比增长14.29%,位列全球自免药物销售额前十。
但硬币的另一面,却是IgE抗体药物目前仍缺乏更优的迭代药物。作为第一代药物的奥马珠单抗,同样存在疗效持续时间有限,治疗周期长,长期使用副作用明显等待改善的问题。
曾被寄予厚望的诺华、罗氏第二代IgE抗体药奎利珠单抗(Quilizumab)、第三代利格珠单抗(Ligelizumab)却进展不畅——前者目前已无可查询的公开信息,后者虽已被FDA纳入突破性药物名单,但2023年至今则陆续终止了两项Ⅲ期临床研究,上市时间仍是未知数。
聚焦国内市场,在研的同类药物或许会成为需求迭代突破口。
天辰生物的新一代抗IgE抗体LP-003,3月2日刚刚披露了治疗慢性荨麻疹(CSU)的II期临床中期数据,结果显示其关键疗效指标优于奥马珠单抗,且有长效优势。
另外还有翰森制药从麓鹏制药引入的HS-10561胶囊,也拟用于开发治疗慢性自发性荨麻疹,不过并非IgE抗体药,而是小分子BTK抑制剂,2月25日才刚获CDE批准临床,仍有待较长时间的临床试验过程验证。
因此,诺华的瑞米布替尼片此时递交国内上市申请,可谓赶在了新一代IgE抗体过敏药及同类BTK抑制剂入局之前,且其临床中长达52周的疗效改善周期,良好的耐受性,以及口服的便利性,也被认为或可填补目前未被满足的临床需求。
但需要指出的是,目前瑞米布替尼片获批的慢性自发性荨麻疹适应症,仅属于过敏药市场的“冰山一角”,未来覆盖更多的适应症,才有望获得更具竞争优势的市场份额。
尤其在整个过敏疾病领域,儿童与老年人群属高发群体,过敏发病率分别达28%和15%,这也意味着儿童、老年用药需求有着可挖掘的巨大潜力;同时副作用更小,用药便捷性更高的升级款药物,也将更吸引患者选择。
对比之下,先于诺华两天,2月25日获CDE受理新适应症上市申请的赛诺菲盐酸非索非那定口服混悬液,已有抢食更多市场蛋糕的战略意味。
该药作为二代新型抗组胺药,其片剂已于2021年获中国药监局批准上市,用于过敏性鼻炎及慢性特发性荨麻疹。根据美国FDA此前批准的该药口服混悬液剂型,用于治疗2~11岁儿童季节性过敏鼻炎,以及6个月~11岁儿童慢性特发性荨麻疹。
此次中国市场新剂型及新适应症若顺利获批,无疑将覆盖更多的患者群体,也意味着该药将成为诺华瑞米布替尼片接下来的最大竞争对手之一。
结语
曾有药企负责人表示,过敏药赛道目前相对小而美,竞争格局相对友好,且临床需求巨大,可以说是一个蓝海市场。
但任何市场都不缺少竞争者,随着越来越多的国际创新药物陆续进入临床并瞄准中国这一潜力市场,过敏药领域的竞争也将持续加大。
尤其国民健康意识不断增强,医疗技术的持续提高,也对抗过敏药物的迭代更新提出了更高的要求,无论先发与否,副作用更少,依从性更高的药物,将能获得更大的竞争优势。
(转自:新康界)