
近日,新加坡南洋理工大学徐梽川院士接连在《Nature Communications》上发表两篇论文,分别涉及电催化合成氨、合成尿素领域,一起瞧瞧!
1 高熵氧化物上的Cu-Co原子对,促进电催化硝酸盐产氨

电化学将硝酸盐转化为氨是消除水中硝酸盐污染物的一种方法。Cu-Co协同效应在氨生成过程中表现优异。然而,很少有研究关注高熵氧化物的这种效应。 新加坡科技研究局(A*STAR)Jia Zhang、Zhi Wei Seh,新加坡南洋理工大学徐梽川教授等人报道了在高熵氧化物Mg0.2Co0.2Ni0.2Cu0.2Zn0.2O中自旋相关的Cu-Co协同效应对硝酸盐到氨的电化学转化。相比之下,Li掺杂的MgCoNiCuZnO表现出较差的性能。通过电子结构的关联,发现Co自旋态对于Cu-Co生成氨的协同效应至关重要。
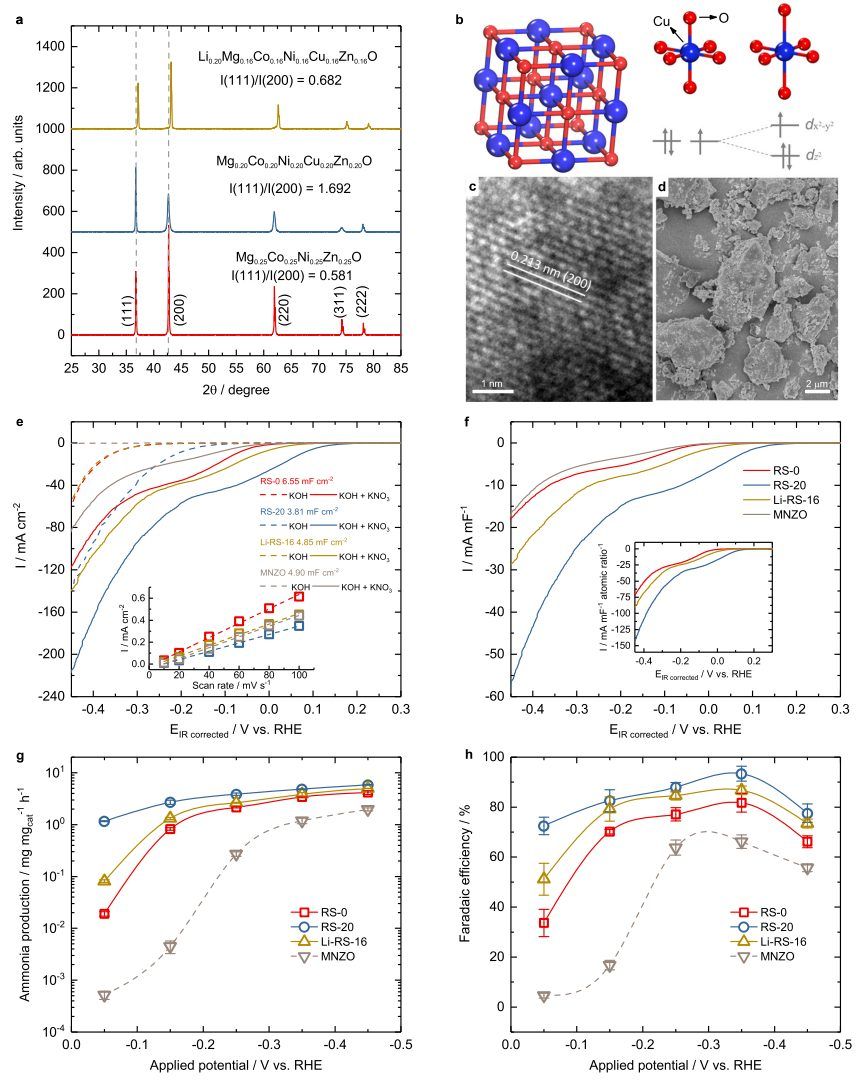
在Mg0.2Co0.2Ni0.2Cu0.2Zn0.2O中,高自旋Co的Cu-Co原子对有利于氨的生成,而在Li掺杂MgCoNiCuZnO中,低自旋Co降低了Cu-Co对氨生成的协同作用。这些发现为利用协同效应和内部自旋态进行选择性催化提供了重要的见解。这也表明了电催化和热催化在氨合成中磁效应的普遍性。

相关工作以《Spin-related Cu-Co pair to increase electrochemical ammonia generation on high-entropy oxides》为题在《Nature Communications》上发表论文。
2 时隔33天再发Nature Communications!

电化学合成是一种很有前途的可持续生产尿素的方法,但其确切的机理尚未完全揭示。 新加坡南洋理工大学徐梽川院士团队基于恒电位法结合隐式溶剂模型,探讨了Cu表面亚硝酸盐和二氧化碳的电化学偶联合成尿素的机理。研究发现,通常被忽视的工作电极电位对反应机理和活性都有影响。对反应途径的进一步计算研究表明,*CO-NH和*NH-CO-NH是关键中间体。此外,通过在微动力学模型中分析不同电位、压力和温度下的转化频率,证明了活性随着温度的升高而增加,并且Cu(100)在三种Cu表面中表现出最高的尿素合成效率。双电层电容在尿素合成中也起着关键作用。基于这些发现,作者提出了提高Cu电极上尿素合成效率的两个基本策略:提高Cu(100)表面比和提高反应温度。
相关工作以《Potential and electric double-layer effect in electrocatalytic urea synthesis》为题在《Nature Communications》上发表论文。值得注意的是,这也是徐梽川院士在《Nature Communications》上发表的第10篇论文。

图文导读

图1. 尿素合成的活性位点及反应机理
铜是一种常用的电催化剂,用于将二氧化碳和亚硝酸盐离子电还原为尿素。因此,本文选择Cu(111)、Cu(110)和Cu(100)低指数晶面作为模型电催化剂,研究电化学合成尿素的机理。Cu(111)、Cu(100)和Cu(110)面如图1a所示。NO2-和CO2电化学偶联生成尿素的整个反应机理可分为4个阶段:NO2-和CO2还原、第一次C-N键生成、第二次C-N键生成、最后加氢生成尿素(图1b)。
其中,NO2-(NO2-RR)和CO2(CO2RR)还原反应是至关重要的竞争反应,相应的N-和C-中间体的偶联反应在尿素合成中起关键作用。因此,研究NO2-RR和CO2RR在这些表面上的作用机制对于理解尿素合成过程至关重要。 在这项工作中,研究了所有N-和C-中间体在三种表面的不同活性位点上相应的潜在吸附构型(图1a)。人们普遍认为电化学反应是由动力学和热力学共同控制的。无论反应类型是1型还是2型(图1d),过渡态(TS)与初始态(IS)之间的能量差大于终态(FS)与初始态(IS)之间的能量差。因此,本研究主要集中在动力学过程上,动力学过程是电化学反应的主要速率决定因素。

图2.NO2-RR、CO2RR及第一步C-N耦合的动力学研究
NO2-RR和CO2RR的质子耦合电子转移(PCET)步骤可以通过E-R或者L-H机制进行,如图1c中*NO2的氢化反应为例。为了在E-R机制中准确模拟溶剂化水分子中H原子的氢键,将两个显式H2O分子和一个H3O+分子与隐式溶剂结合在一起。图2a、b总结了三个表面上通过E-R和L-H机制对NO2-RR和CO2RR的PCET步骤的计算动力学势垒。
对于NO2-RR,结果表明,在Cu(111)表面上,除了*NH的加氢反应(RDS)外,几乎所有的PECT步骤都有利于E-R机制,该步骤是NO2-RR的速率决定步骤(RDS),具有0.754 eV的高动力学势垒,如图2a所示。在Cu(110)和Cu(100)表面,除了NO2-RR过程中的*N加氢外,大多数PECT步骤也倾向于E-R机制。NO2RR的RDS为*NH2和*NH在Cu(110)和Cu(100)表面的加氢反应,动力学势垒分别为0.346和1.082 eV。为了确定电位耦合步骤,将大于0.75 eV的动力学势垒设置为快速电化学过程的标准,并认为大于0.75 eV的动力学势垒在动力学上是不可行的。因此,Cu(111)和Cu(100)表面的*NH2不包含在下一个C-N耦合步骤中,因为*NH2的形成受到高动力学势垒(>0.75 eV)的阻碍。 对于CO2RR,除了Cu(110)表面的CO2加氢外,所有的PECT步骤都有利于E-R机制。值得注意的是,实验中*CO可以解吸为CO(g)或进一步氢化为*HCO。因此,了解*CO能否在三个表面上解吸和氢化,对于后续的C-N耦合步骤非常重要。这表明,在这些表面上,*CO加氢成*HCO更倾向于E-R机制,而CO(g)的解吸由于高动力学势垒(>0.75 eV)而难以进行(图2b)。下面重点讨论CO2RR中CO2→*COOH→*CO→*HCO的反应途径。 本研究采用恒电位法模拟实验恒电位条件下的相关动力学势垒。通过NO2-RR和CO2RR最有利机理计算出的IS和TS在三个带电表面上的总能量。
在此基础上,计算了NO2-RR和CO2RR电化学反应步骤的动力学势垒(图2d、e)。 对于NO2-RR,可以发现动力学势垒受电极电位的影响,特别是*NO2/*HNO2/*N在Cu(111)、*HNO2/*NO/*NOH在Cu(110)和*NO2/*HNO2/*N在Cu(100)上的加氢。这揭示了电极电位对NO2-RR活性的重要作用。对于CO2RR,在Cu(111)和Cu(110)表面上,CO2加氢到*COOH的动力学势垒比*COOH加氢到*CO的动力学势垒更正,这意味着*COOH将快速转化为*CO,而不与这两个表面上的N-中间体偶联(图2e)。

在Cu(111)表面,*CO-NH只能与*NH偶联,与*NH加氢生成*NH2相比,其动力学势垒较低,为0.357 eV(图3a)。第二次C-N偶联反应的IS和TS能量及其对应的动力学势垒随外加电极电位的变化如图3c所示。显然,*NH-CO-NH偶联的相关动力学势垒总是低于*NH加氢,因此更有利于偶联而不是质子化。 *NH-CO-NH一旦形成,经过L-H和E-R两步加氢形成尿素(CO(NH2)2),其动力学势垒分别为0.306 eV和0.278 eV(图3b),相应的动力学过程构型如图3e所示。此外,在0~-1.50 V的电极电位范围内,*NH-CO-NH后续两个连续加氢步骤的动力学势垒均小于0.45 eV(图3d),表明其快速的动力学过程。因此,*CO-NH和*NH-CO-NH是尿素合成的两个关键中间体。在Cu(111)表面上合成尿素的相应原理图如图3f所示。

为了进一步探索尿素生产的选择性和效率,通过微动力学分析估算了实验条件下Cu(111)和Cu(100)表面上尿素和氨合成的TOF。图4a、d和图4b、e分别揭示了在温和条件下(300 K和1 pa),Cu(111)和Cu(100)表面合成尿素和氨的TOF随外加电极电位的变化。在这里,施加的电极电位范围为0至-1.50 V,以0.25 V为步长。值得注意的是,施加的电极电位是尿素和氨合成的关键参数。结果表明,Cu(100)表面比Cu(111)表面更具活性。
在Cu(111)和Cu(100)表面上,尿素合成的TOF在-1.50和-0.50 V时达到最大值,分别为4.29×10-57 s-1 site-1和8.61×10-4 s-1 site-1(图4a、d)。此外,Cu(111)和Cu(100)表面上的TOF在-1.50和-0.75 V时达到最大值,分别为2.26×10-71 s-1 site-1和1.50×10-7 s-1 site-1(图4b、e)。同时也给出了CO2RR在Cu(111)和Cu(100)表面的TOF,在施加的电位范围内,两个表面都表现出负的TOF值,表明反应的可逆性。结果证实了本文的发现,并与之前的研究一致,表明*CO难以解吸,并倾向于在Cu表面进一步反应。

在电化学反应中,由于电解质体相溶液中的离子与电极的带电表面之间的相互作用,产生了双电层(EDL)。EDL由两个带电层组成:内Stern层和外扩散层(图5a)。在实验中,通常更薄的EDL可以产生更大的电场强度和更大的电容,从而促进电荷迁移和离子扩散。因此,了解EDL在电催化中的作用,对尿素合成工艺的设计和优化具有重要意义。对Cu(111)、Cu(110)和Cu(100)表面的EDL进行了综合分析。 图5b、c显示了EDL中不同中间体Cu(111)、Cu(110)、Cu(100)表面在NO2-RR和CO2RR过程中的电容。
各种中间体与电极表面的相互作用导致不同的EDL电容。对于NO2-RR,Cu(110)表面表现出最高的电容(32.003~37.803 µF/cm2),其次是Cu(100)表面(28.454~34.854 µF/cm2),最后是Cu(111)表面(24.228~31.258 µF/cm2)。对于CO2RR到*COOH和*CO,电容大小顺序为Cu(100)>Cu(110)> Cu(111)表面。 电化学反应的动力学和有利的反应途径主要受EDL的结构和电极与电解质之间的内在相互作用的影响。DL内部的几种基本相互作用,包括静电力、共价键和非共价键,共同形成了界面结构的动态性质。具体来说,在尿素合成过程中,共价相互作用涉及直接成键,包括轨道重叠和吸附剂之间的化学相互作用,这强烈依赖于界面场,电极表面的特定性质。值得注意的是,参与NO2-RR和CO2RR的中间体在Cu(111)和Cu(100)表面上的EDL电容是相当的。
然而,Cu(110)表面在NO2-RR和CO2RR工艺之间表现出明显的电容差异。这表明N/ C中间体在Cu(111)和Cu(100)表面的耦合行为可能由于它们相似的物理化学性质和界面行为而增强。然而,Cu(110)表面由于电容的差异可能会阻碍N-中间体与C-中间体的相互作用。 为了更好地说明EDL电容与电动力学之间关系的物理根源,研究了中间体吸附表面的表面电荷密度(σ)。σ可以用来描述双层静电效应对电动力学的影响,因为它描述了反应部位局部界面场的变化。Cu(111)和Cu(100)表面吸附的C-和N-中间体具有正σ特征,表现出相同的界面场。这种均匀性表明C-和N-中间体可以在这些表面上共存,从而为耦合步骤提供了空间可能性。 相反,C-和N-中间体吸附Cu(110)表面显示相反的界面场,这可能阻碍耦合步骤。特别是,*CO2吸附Cu(110)表面的负σ可能是C-中间体吸附Cu(110)表面EDL电容减小的原因(图5)。因此,电催化剂表面、中间体和电解质之间的相互作用改变了反应机理途径,最终决定了反应向特定产物的优先方向。这一发现进一步说明了Cu(110)表面合成尿素的电催化性能较差。
文献信息
Potential and electric double-layer effect in electrocatalytic urea synthesis,Nature Communications,2024.
