最近几年,人们对肠道菌在癌症治疗中的作用越来越重视。特别是免疫治疗中,已经有一些临床试验通过粪菌移植改善了免疫治疗的效果。

但其实,化疗作为癌症治疗的基石手段之一,肠道菌群也深度参与到化疗药物的抗肿瘤作用过程,发挥着对化疗疗效不同的调节作用。那么在癌症的化疗中,肠道菌群都是如何影响到了化疗的疗效?
微生物群可以直接参与介导对化疗药物的治疗反应比如,肠道菌群协助增强化疗药物对癌细胞的凋亡作用。以氟尿嘧啶举例,5-氟尿嘧啶(5-FU)是一种常用的化疗药,它是一种核苷类似物,在癌细胞复制自身DNA时可以混入其中,造成DNA复制错误,诱导癌细胞凋亡。
有研究发现,嗜酸乳杆菌和干酪乳杆菌的混合物不会诱导结直肠癌细胞的凋亡,但与5-FU联用时可以让5-FU诱导癌细胞凋亡的能力增强40%[1]。

图1.益生菌增强5-FU诱导癌细胞凋亡的能力
这其中的机制可能与肠道菌群产生的后生元物质有关。
后生元是益生菌经加工处理后的益生菌代谢物成分统称,包括菌体与代谢产物。研究中还发现,使用辐照灭活(对后生元影响较小)的益生菌混合物也能产生同样的增加疗效的作用,而微波灭活(会破坏后生元)的益生菌混合物增强疗效的作用较弱。
肠道菌群可以参与调节化疗和放疗中的治疗后毒性某些化疗药物的一些副作用非常严重,以至于它们会阻碍患者接受适当的剂量或治疗持续时间。而这其中的一部分原因就是化疗药物本身会对肠道菌群产生干扰[2]。
以伊立替康为例,这是一种常用于治疗结肠癌的化疗药物,它引入了一种活性化疗药物SN38,当它排泄到胃肠道时会导致严重腹泻。这导致患者经常需要降低剂量或调整剂量,同时双歧杆菌和乳杆菌物种的丰度也会降低,导致肠道菌群紊乱。
而化疗引起的免疫力下降也使得部分患者需要使用抗生素预防感染,当抗生素的频繁使用影响到健康肠道菌群时,治疗的疗效也会受到影响。
2015年,德国科隆大学分析了800名接受环磷酰胺治疗的慢性淋巴细胞白血病患者的数据,其中45人使用过抗革兰氏阳性菌的抗生素。相比其它患者,这45人的ORR从90.2%降低到了74.3%,中位PFS从44.1个月缩短到14.1个月,中位OS从91.7个月缩短到56.1个月,疗效出现明显的下滑[3]。
在另外122名接受铂类化疗的复发性淋巴瘤患者中,研究人员也发现了类似的现象。而予以相应的益生菌补充可能减少这种对疗效的负性影响。
补充益生菌群这种对治疗毒性的减缓作用也同样在放疗中被发现。一些研究已经证明了包括鼠李糖乳杆菌GG和VSL#3制剂(由链球菌、乳酸杆菌和双歧杆菌组成)在内的益生菌如何保护肠道黏膜免受放射治疗引起的毒性作用[4]。
此外,对于接受放疗和化疗的头颈部癌症患者,联合口服短乳杆菌(Lactobacillus brevis)CD2含片可提高治疗疗效并降低治疗诱发的黏膜炎的风险[5]。
在化免联合时代,益生菌群的补充可以进一步改善免疫治疗的疗效化疗药都属于细胞毒性药物,可以直接对癌细胞产生杀伤,但是化疗的疗效并不全来自对癌细胞的直接杀伤,免疫系统也在其中有着重要的作用。化疗药除了杀伤癌细胞外,也会杀死骨髓源性抑制细胞(MDSC)、调节性T细胞(Treg)等免疫抑制细胞,重塑肿瘤微环境[6]。被化疗杀死的癌细胞也会暴露出更多的肿瘤抗原[7],这些都能帮助免疫系统对抗肿瘤,这就是化免联合治疗的理论基础。
而益生菌群在此时的加入可以进一步促进抗肿瘤化免治疗的作用。植物乳杆菌、鼠李糖乳杆菌、嗜酸乳杆菌等许多不同的益生菌,都可以在减少化疗毒性的同时,通过促进抗原呈递、激活NK细胞等途径,增强免疫系统对肿瘤的杀伤能力[8],对疗效产生正面增效作用。

图2.益生菌群深度参与抗肿瘤免疫治疗、化疗和治疗后毒性中[9]。
A.免疫治疗:益生菌鼠李糖乳杆菌通过激活cGAS/STING/TBK1/IFNregulatory-factor-7依赖性信号通路触发树突状细胞产生I型干扰素(IFN);这最终增强了程序性细胞死亡蛋白1(PD-1)免疫疗法的抗肿瘤活性。
B.化疗:海氏肠球菌(Enterococcus hirae)和Barnesiella intestinihominis可诱导Th1和Th17的产生,并激活肿瘤特异性CD4+和CD8+T细胞,这些细胞共同增强环磷酰胺的疗效。此外,了解具核梭杆菌如何通过TLR4-MY88信号通路激活自噬从而导致化疗耐药,可用于通过将化疗与自噬抑制剂联合来增强治疗反应。
C.治疗后毒性:益生菌,如鼠李糖乳杆菌GG和VSL#3制剂(由链球菌、乳杆菌和双歧杆菌组成)可保护肠道黏膜免受放疗引起的毒性。此外,植物乳杆菌(Lactobacillus plantarum)可以通过促进调节肠-脑-皮肤轴的催产素分泌来促进肿瘤手术后的伤口愈合,还可以防止通常与手术部位感染有关的病原体在手术部位定植。
*cGAMP:环鸟苷酸-腺苷酸;cGAS:环鸟苷酸-腺苷酸合成酶;PD-L1:PD-1配体1;STING:干扰素基因刺激因子。
益生菌群可以直接产生抗癌代谢物益生菌的代谢物也是其影响癌症治疗的一大法宝。比如很多益生菌代谢都会产生的丁酸盐,在免疫治疗中就具有增强患者免疫力,改善免疫治疗效果的作用。而除此以外,丁酸盐在肿瘤的化疗中也有特殊的作用。
有研究发现,将乳酸菌的培养液上清和丁酸盐都能降低癌细胞的活力[10]。他们与阿霉素联合应用时能进一步增加癌细胞线粒体中活性氧(ROS)的产生,增强阿霉素对癌细胞的杀伤能力,甚至逆转肿瘤对阿霉素的耐药。
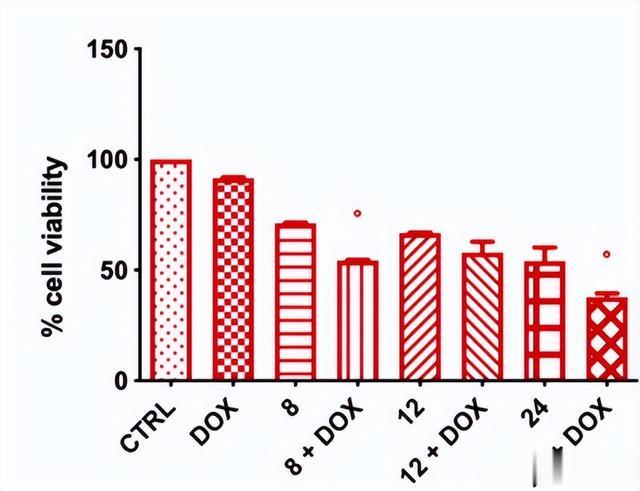
图3.丁酸盐逆转阿霉素耐药
综上,肠道细菌在癌症治疗中的重要性无论怎样强调都不为过,因为它具有开创癌症治疗新时代的潜力。有许多正在进行的临床试验开始将研究结果从实验室转化到临床。咚咚严选专为放化疗患者定制的乐愈达优护益生菌包含8种不同的复合益生菌菌株,其中植物乳杆菌、嗜酸乳杆菌、鼠李糖乳杆菌等都被发现有增强化疗疗效的作用。


相信在化疗的路上,乐愈达优护益生菌会是您的“好帮手”。
参考文献:
[1]. Baldwin∗ C, Millette∗ M, Oth D, et al. Probiotic Lactobacillus acidophilus and L. casei mix sensitize colorectal tumoral cells to 5-fluorouracil-induced apoptosis[J]. Nutrition and cancer, 2010, 62(3): 371-378.
[2]. Stringer A M, Gibson R J, Bowen J M, et al. Chemotherapy-induced modifications to gastrointestinal microflora: evidence and implications of change[J]. Current drug metabolism, 2009, 10(1): 79-83.
[3]. Pflug N, Kluth S, Vehreschild J J, et al. Efficacy of antineoplastic treatment is associated with the use of antibiotics that modulate intestinal microbiota[J]. Oncoimmunology, 2016, 5(6): e1150399.
[4]. Delia P, Sansotta G, Donato V, et al. Use of probiotics for prevention of radiation-induced diarrhea[J]. World journal of gastroenterology: WJG, 2007, 13(6): 912.
[5]. Sharma A, Rath G K, Chaudhary S P, et al. Lactobacillus brevis CD2 lozenges reduce radiation-and chemotherapy-induced mucositis in patients with head and neck cancer: a randomized double-blind placebo-controlled study[J]. European journal of cancer, 2012, 48(6): 875-881.
[6]. Zheng Y, Dou Y, Duan L, et al. Using chemo-drugs or irradiation to break immune tolerance and facilitate immunotherapy in solid cancer[J]. Cellular immunology, 2015, 294(1): 54-59.
[7]. Jackaman C, Majewski D, Fox S A, et al. Chemotherapy broadens the range of tumor antigens seen by cytotoxic CD8+ T cells in vivo[J]. Cancer Immunology, Immunotherapy, 2012, 61: 2343-2356.
[8]. Zitvogel L, Daillère R, Roberti M P, et al. Anticancer effects of the microbiome and its products[J]. Nature Reviews Microbiology, 2017, 15(8): 465-478.
[9]. Liu L, Shah K. The potential of the gut microbiome to reshape the cancer therapy paradigm: A review[J]. JAMA oncology, 2022, 8(7): 1059-1067.
[10]. Doublier S, Cirrincione S, Scardaci R, et al. Putative probiotics decrease cell viability and enhance chemotherapy effectiveness in human cancer cells: role of butyrate and secreted proteins[J]. Microbiological Research, 2022, 260: 127012.
