编者按
2024年7月20日,在中国肝炎防治基金会组织的“世界肝炎日”宣传会议上,北京大学感染病研究中心鲁凤民教授首次披露了 “未名项目” 的阶段性成果,并对扩大治疗后 “组织学免疫耐受” 慢性HBV感染者可能的病毒学应答不佳提出建议。本刊特邀请鲁凤民教授撰文,详细介绍了该项目的重要成果及其背后的思考。

基于现有一线药物在慢性乙型肝炎(CHB)患者临床治愈上的局限性,各大指南定义的抗病毒治疗的主要目的是:最大限度地长期抑制HBV复制,减轻肝细胞炎症坏死及肝脏纤维组织增生,延缓和减少肝功能衰竭、肝硬化失代偿、肝细胞癌(HCC)和其他并发症的发生,改善患者生活质量,延长其生存时间。
其中,核苷(酸)类似物(NAs)是目前临床应用最为广泛的一线抗病毒治疗药物,其作用机理是通过与感染肝细胞内的天然脱氧核糖核苷三磷酸(dNTP)竞争性结合病毒p蛋白,阻滞子代病毒基因组——部分松弛环状的双链DNA(relaxed circular DNA,rcDNA)的合成。然而,由于缺乏宿主免疫,特别是CD8+T细胞细胞毒作用(CTL)介导的对感染肝细胞的直接杀伤和清除,以及稀释HBV复制源头闭合环状DNA (covalently closed circular DNA,cccDNA)池的辅助,NAs竞争性抑制的作用原理使其难以完全阻止新的子代病毒DNA的合成。
在接受 NAs治疗的CHB患者中总有部分人群出现低病毒血症(LLV)现象。与完全病毒学应答相比,LLV患者的疾病进展往往难以被完全阻断,肝纤维化和肝硬化难以得到有效逆转,原发性肝细胞癌的风险仍然较高。LLV成为NAs治疗实践中亟待解决的临床问题。我国学者在庄辉院士的指导下,强调了LLV是指CHB患者接受≥48周的NAs治疗后,患者的循环血HBV DNA水平虽低于2000 IU/mL ,但仍高于定量下限(LLOQ),同时排除耐药和依从性差。
考虑到接受NAs治疗的CHB患者在出现LLV后的疾病进展和发生HCC的风险,在中国肝炎防治基金会的大力支持下,由北京大学牵头,联合国内多家医院发起了“未名项目”。该项目旨在通过“集全国专家之力、共同探索乙肝治疗新策略”,尝试解决NAs治疗下的低病毒血症问题。在庄辉院士、陈新月教授的指导下,经过多轮科学论证,“未名项目”最终于2021年7月10日在杭州的“珠峰”年会上启动(图1)。

图1. “未名项目”启动仪式上专家合影
“未名项目”的主要研究内容是:通过对比加用不同类型的另一NAs药物(NAs联用)、或加用PEG-IFNα(NA联用长效干扰素)两种不同治疗方式,探究解决LLV的治疗途径与策略,以使更多的患者在抗病毒治疗中最大获益。

图2. “未名项目”研究设计图
其中联合PEG-IFNα 的常规疗程为48周。对于应答良好的人群,根据指南、医生决策和患者的依从性,适当延长治疗时间;对于应答不佳人群,在干扰素使用后24周决定是否停止治疗。
项目启动后恰逢3年新冠疫情,患者入组遇到了较大的障碍。在基金会领导的大力支持和参加单位的共同努力下,伴随着疫情结束,项目入组步入正轨。截止到今年7月已完成了超过80%的患者入组。受中国肝炎防治基金会之邀,该项目初步的研究结果(表1)在2024年7月20日的“世界肝炎日”宣传会议上公布。

表1. NAs联合治疗组、NAs联合干扰素治疗组第24、48、72周的HBV DNA阴转率比较
从上述结果看,尽管两组患者的基线并无明显差异,但与NAs治疗组相比,LLV患者接受联合干扰素治疗24周时即出现了促使患者实现完全病毒学应答的优势。治疗随访至48周时,更有超过63%的LLV患者循环血中的HBV DNA水平降到了LLOQ(20 IU/mL)以下。这种优势在停止PEG-IFNα 24周后依然存在。不仅如此,LLV患者在接受联合干扰素治疗后的HBV DNA下降幅度也远大于NAs治疗组(见表2)。

表2. NAs联合治疗组、NAs联合干扰素治疗组第24、48、72周的HBV DNA下降幅度比较
以上结果提示,NA联合干扰素治疗能够更有效地解决接受NAs治疗的CHB患者出现的LLV问题。不仅如此, NA联合干扰素还能够使LLV患者循环血中的HBsAg水平显著下降,并能使部分患者实现临床治愈。但是值得关注的是,LLV患者后续转为NA联合干扰素后的HBsAg消失率低于完全病毒学应答的患者(表3)。这除了与LLV患者更高的循环血HBV DNA和HBsAg水平有关外,也提示我们要积极应对LLV的问题,以使更多的患者实现临床治愈。(注:由于是动态队列,下面图表中的“HBsAg消失率”并非累计结果)。

表3. NAs联合干扰素治疗组中SVR组与LLV组第24、48、72周的HBsAg阴转率比较
结合我们和其他实验室的前期结果,我们认为NA联合长效干扰素在解决LLV方面的优势在于其对宿主免疫的调节。如图3所示,激活的HBV特异性免疫可以通过CTL应答杀伤感染肝细胞,清除和稀释cccDNA池从而从源头上减少HBV DNA的复制,且代偿性增殖状态的残余肝细胞因HBV受体NTCP的表达下降对从头感染有一定的抵抗作用。总之,伴随肝脏炎症损伤和肝细胞代偿性增殖及新感染减少,cccDNA池快速下降,有助于NA治疗下的完全病毒学应答。
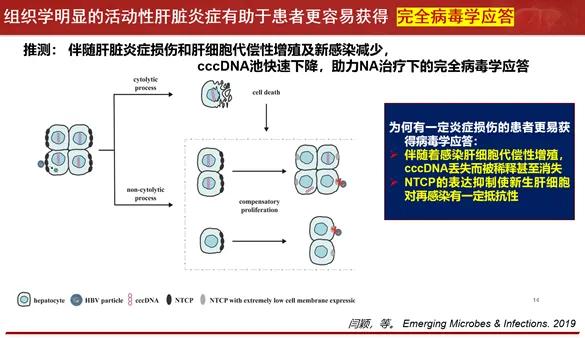
图3. 部分患者更容易获得完全病毒学应答的机制分析
与此同时,HBsAg特异的CD8+T细胞也有助于免疫清除表达HBsAg的携带整合HBV DNA的单克隆细胞集落。理论上,这不仅有助于长远的HCC发生风险的下降,也有助于CHB临床治愈的实现(图4)。

图4. 尽早启动抗病毒治疗降低慢性HBV感染者HCC发生风险的科学依据
(周召,等.临床肝胆病杂志第39卷第1期,2023年1月)
“未名项目”阶段性成果对扩大抗病毒治疗的影响无论是我国更新的《慢性乙肝防治指南(2022年版)》,还是刚刚结束的2024欧洲肝脏研究学会年会(EASL2024),及WHO的新版指南,扩大抗病毒治疗已经成为大势所趋。我国的扩大抗病毒治疗一改过去的“treat selected”[有活动性肝脏炎症(G≥2)、纤维化/肝硬化(S≥2),及其他肝外表现]或“treat if”(有肝癌、肝硬化家族史),而是推荐所有>30岁的慢性HBV感染者接受抗病毒治疗。如图5所示,对于我国多由母婴垂直传播和婴幼儿时期暴露为主要传播途径的慢性HBV感染者而言,上述策略带来的最大影响是将会有更多的“组织学免疫耐受”状态(《临床肝胆病杂志》,接受待发表)的慢性HBV感染人群被纳入治疗。

图5. 最新的慢性HBV感染自然史分期
包括陈力元教授(2014年) 在内的多名学者开展的多项研究也告诉我们,对于这些“免疫耐受”状态的慢性HBV感染者,经过相对较长时间的NAs治疗后,他们中的多数能够达到完全病毒学应答(HBV DNA<60 IU/mL)。另一些人即使没有达到完全病毒学应答,其病毒载量也有明显的下降。理论上讲,这同样会使患者获益。近期的研究也显示,从公共卫生角度来看,与将抗病毒治疗延迟到活动性肝炎期相比,在免疫耐受期开始抗病毒治疗更具有成本效益。

图6. “免疫耐受”者接受NA治疗多能获得完全病毒学应答
正如本文前述的理论基础所示:“组织学免疫耐受”状态的慢性HBV感染者对NAs治疗应答不佳。这一点我们临床医生深有体会。不同于既往定义LLV时的NAs治疗,多数存在肝脏免疫病理损伤的CHB患者,如果对抗病毒治疗应答不完全(即LLV),持久的病毒复制会带来肝组织的持续炎症损伤和更大的HCC发生风险。而扩大治疗后的“组织学免疫耐受”状态的慢性HBV感染者并不存在明显的肝脏炎症。其在抗病毒治疗下的完全病毒学应答延迟,可能原因是:① 基线HBV DNA水平高;② 缺乏炎症免疫介导的感染肝细胞的清除和后续的肝细胞活跃代偿性增生,使得cccDNA池无法实现快速下降,因此不能在短时间内获得完全病毒学应答(CVR)。基于以上机制上和后续疾病进展风险的差异,我们建议将后者称为完全病毒应答迟缓(CRP),以便与在CHB患者中出现的、与HCC相对高风险相关的LLV加以区别。唯有如此,才会避免患者因“LLV”污名化带来的抗病毒治疗迟疑,临床医生也不会因为可预期的较长时间的病毒检测持续阳性而对扩大抗病毒治疗心存疑虑。

表4. 低病毒血症(LLV)与完全病毒学应答延迟(CRP)特征差异对比
根据前述的“未名项目”的阶段性成果,我们或许可以建议:对于那些依从性好的接受了两年及更长时间NAs治疗的完全病毒应答迟缓的组织学免疫耐受人群,或可考虑通过联合长效干扰素促进其实现完全病毒学应答?
正如贾继东教授再三所强调的—— “医学研究无禁区,临床实践有规范” 。因此,这里需要指出的是,临床医学是基于证据的经验科学,上述针对病毒学应答延迟的组织学免疫耐受人群的治疗建议是否可行,尚需要更多的临床实践证伪后,才能成为一项临床实践。
