在我们身体这个奇妙的微观世界里,细胞们时刻都面临着 “生死抉择”。细胞凋亡与细胞焦亡,作为细胞程序性死亡的重要形式,它们虽然名字听起来有些相似,但实则有着诸多不同,就像是细胞走向死亡的两条截然不同的道路,各自发挥着独特作用,深刻影响着生命的进程。
定义
(该图来源网络)
细胞凋亡,堪称细胞世界里的 “优雅谢幕”。它是一种为了维持内环境稳定,由基因主导的细胞自主有序死亡过程。就如同树木在秋季落叶,凋亡是细胞主动遵循 “生命剧本”,去除机体中那些不再需要、受损或是老化的细胞,以保障整个机体的正常运转。在胚胎发育阶段,手指与脚趾最初是相连的,正是通过细胞凋亡,让多余的细胞程序性死亡,才塑造出我们如今灵活的手足形态;在人的成长过程中,骨髓内一些成熟的血细胞会按程序凋亡,为新生血细胞腾出空间,确保血液系统功能稳定。
反观细胞焦亡,它像是细胞的 “壮烈牺牲”,属于炎症程序性死亡。通常是在遭遇各种病理刺激时才被触发,比如细菌、病毒等微生物的猛烈侵袭,又或是身体内部出现病变损伤等异常状况。细胞焦亡一旦启动,细胞就会迅速发生一系列剧烈变化,最终细胞膜破裂,将细胞内的炎性介质如洪水决堤般释放到周围组织环境中,引发强烈的炎症反应,犹如吹响免疫防御的 “冲锋号”,召集免疫细胞奔赴战场对抗病原体,只不过这是以细胞自身的破碎为代价。当人体肺部遭受细菌感染时,肺泡巨噬细胞可能发生焦亡,释放出白细胞介素等炎症因子,引发局部炎症,虽然短期内造成不适,但长远来看是机体对抗感染的重要手段。
形态变化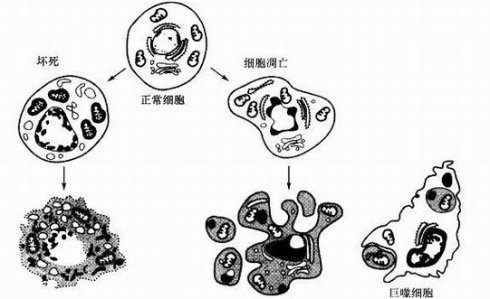
(该图来源网络)
在微观视角下,细胞凋亡与细胞焦亡呈现出迥异的形态画面。
细胞凋亡好似一场悄然进行的 “瘦身运动”。细胞启动凋亡程序后,首先体积逐渐缩小,细胞间连接如同解开的纽带慢慢消失,与周围细胞脱离接触,独自踏上 “谢幕之路”。细胞质密度悄然增加,线粒体膜电位逐渐消失,膜通透性改变,使得细胞色素 C 等物质释放到胞浆之中。细胞核内,染色质高度浓缩,核膜核仁破碎,最终细胞碎片化,形成一个个被膜包裹的凋亡小体,这些凋亡小体就像是细胞留给世界的 “遗书包裹”,被周围的吞噬细胞识别并迅速吞噬清理,整个过程不引发炎症反应,周围组织环境依旧井然有序,仿佛什么都没有发生过。
反观细胞焦亡,那场面可谓 “惊天动地”。细胞受刺激后,短时间内如同充气的气球般膨大、变形,细胞膜上迅速形成众多微小孔隙,使得细胞膜失去原本严谨的调控能力,无法再维持细胞内环境的稳定。紧接着,细胞器也在这混乱中扭曲变形,不堪重负。细胞核虽然大致保持完整形态,但其内部的 DNA 却开始随机降解,完全没有凋亡时的 “条理”。随着时间推移,细胞膜再也承受不住内部压力,轰然破裂,细胞内容物裹挟着大量炎性介质,毫无保留地倾泻到细胞外,瞬间点燃周围的炎症 “烽火”,吸引免疫细胞蜂拥而至。
分子机制
(该图来源网络)
深入到分子层面,细胞凋亡与细胞焦亡的 “操控系统” 大相径庭。
细胞凋亡的分子调控网络精密复杂,犹如一台精心编排的舞台剧。其中,Bcl-2 家族蛋白堪称关键 “导演”,成员们分为促凋亡和抗凋亡两大阵营,它们在线粒体膜上 “明争暗斗”,调节着线粒体膜的通透性。当细胞收到凋亡指令,如生长因子缺失、DNA 损伤等,促凋亡蛋白 Bax、Bak 等寡聚化,在线粒体膜上打孔,使得细胞色素 C 等凋亡因子 “破膜而出”,激活下游的 caspase 级联反应。起始 caspase(如 caspase-9)如同 “先锋官”,率先激活,接着激活效应 caspase(像 caspase-3、caspase-7),这些酶如同 “刽子手”,对细胞内的各种结构蛋白、核酸等进行切割降解,一步步将细胞推向凋亡结局。同时,细胞内还有 p53 等抑癌基因,宛如 “监察官”,监控细胞状态,一旦发现细胞 DNA 损伤严重无法修复,就会启动凋亡程序,维护基因组的稳定。
细胞焦亡的分子机制则是围绕炎症小体和炎性 caspases 展开。炎症小体作为 “危险感知器”,是由多种蛋白质组成的复合体,在细胞遭遇病原体相关分子模式(PAMP)如细菌的脂多糖,或是损伤相关分子模式(DAMP)如细胞内的尿酸结晶等异常信号时,迅速集结 “开工”。以 NLRP3 炎症小体为例,它激活后会招募并活化 caspase-1,caspase-1 可不简单,一方面它像个 “加工大师”,将无活性的 pro-IL-1β、pro-IL-18 前体切割成有活性的炎性因子 IL-1β、IL-18,引发炎症 “风暴”;另一方面它化身 “破坏先锋”,切割 gasdermin D(GSDMD)蛋白,使 GSDMD 的 N 端游离出来,N 端如同 “破壁钻头”,聚集到细胞膜上打孔,破坏细胞膜完整性,导致细胞肿胀、破裂,炎性介质大量释放,让细胞焦亡的进程如 “开闸泄洪” 般不可阻挡。此外,在非经典途径中,人源的 caspase-4、5 和鼠源的 caspase-11 能直接识别细菌内毒素等危险信号,激活后同样切割 GSDMD 引发焦亡,为机体抵御外敌入侵提供快速响应机制。
不同作用在机体的宏大舞台上,细胞凋亡与细胞焦亡扮演着截然不同却又相辅相成的角色。
细胞凋亡宛如一位 “幕后英雄”,默默守护着机体的日常稳定。在胚胎发育的奇妙旅程中,它精心雕琢着生命的蓝图,塑造出各个精准的器官形态。除了手指脚趾的分离,在神经系统发育时,大量多余的神经元细胞通过凋亡有序退场,让神经通路得以精准构建,保障神经系统正常功能。步入成年,细胞凋亡依旧忙碌,它时刻巡查,精准清除那些衰老、受损或是发生基因突变的细胞,就像为机体做 “大扫除”,不给疾病滋生的温床,让组织器官时刻保持最佳 “工作状态”,是维持机体稳态、延缓衰老的关键力量。
细胞焦亡则像是机体应对危机的 “急先锋”。当病原体如汹涌的潮水般来袭,特别是细菌、病毒等突破防线,在体内安营扎寨时,免疫细胞中的巨噬细胞、单核细胞等前沿 “战士” 迅速拉响警报,启动焦亡程序。如前文提到的新冠疫情中,新冠病毒感染肺部巨噬细胞和血液单核细胞,引发这些细胞焦亡,释放大量炎性介质,虽引发炎症 “风暴”,短期内对机体造成冲击,但长远看是在 “摇旗呐喊”,召集更多免疫细胞汇聚感染部位,增强免疫反应,为对抗病原体提供强大火力支援,是机体免疫防御不可或缺的重要环节。只不过,当焦亡过度失控,也会像脱缰野马,引发败血症、自身免疫性疾病等不良后果,所以机体也在小心翼翼地平衡着焦亡的 “火候”。
学术研究当前,细胞凋亡与细胞焦亡领域的研究正站在新的起点,不断向未知进发。一方面,新技术蓬勃发展,为深入探究二者奥秘提供了有力工具。例如,高分辨率显微镜结合荧光标记技术,让科学家能够实时、动态地捕捉细胞凋亡与焦亡过程中的细微形态变化,从细胞膜上孔隙的形成,到线粒体形态的动态演变,无一遗漏,为精准解析死亡机制提供了直观依据;单细胞测序技术更是大放异彩,可深入剖析单个细胞在凋亡或焦亡进程中的基因表达谱变化,揭示不同细胞个体对刺激响应的异质性,挖掘潜在的新调控基因。
另一方面,新的研究方向不断涌现。在癌症治疗领域,科学家们尝试利用细胞凋亡与焦亡的特性 “定制” 癌细胞死亡程序。通过设计靶向药物,特异性激活癌细胞内的凋亡通路,或诱导其发生焦亡,释放炎性介质,增强免疫原性,吸引免疫细胞攻击癌细胞,实现 “以毒攻毒”;在神经退行性疾病研究中,关注细胞凋亡和焦亡在神经元死亡过程中的角色,探索如何通过调控这两种死亡方式,延缓疾病进程,保护神经功能;在感染性疾病方面,深入研究病原体如何巧妙操纵宿主细胞的凋亡与焦亡平衡,为开发全新抗菌、抗病毒策略开辟道路。
然而,前行之路依旧布满荆棘。二者之间的交互对话机制仍扑朔迷离,在某些复杂疾病环境下,凋亡与焦亡信号通路是如何相互影响、协同调控的,目前尚未完全明晰。此外,如何精准调控细胞的死亡方式也是一大难题,在治疗场景中,稍有不慎,诱导过度的焦亡可能引发致命的炎症风暴,而不当抑制凋亡又可能导致肿瘤细胞逃避清除。但正是这些挑战,吸引着全球科学家们不断钻研,相信随着研究的深入,细胞凋亡与焦亡的神秘面纱将被进一步揭开,为人类健康带来更多希望之光。
结语
(该图来源网络)
细胞凋亡与细胞焦亡,这两种细胞程序性死亡方式不同,它们在定义、形态、分子机制以及生理病理功能上各具特色,相互区别又紧密相连。
