
肿瘤抗原的分类
基因组测序的最新进展表明,在起始和发展过程中,癌症获得了数万种不同的体细胞突变。这些突变中的大多数没有内在的生长优势(乘客突变),通常是肿瘤内基因组不稳定性的结果。
少量的癌症突变干扰正常的细胞调节,并有助于推动癌症生长和对靶向治疗的耐药性(驱动突变)。到目前为止,大约有140个基因已经被鉴定出来,它们可以驱动肿瘤的发生。然而,驱动突变和乘客突变都可以改变氨基酸编码序列,统称为非同义突变,导致肿瘤表达正常细胞不表达的突变蛋白。这些异常蛋白序列被加工成短肽,并与主要组织相容性复合体结合(MHC;在人类中也称为人类白细胞抗原HLA),从而变得可被T细胞识别为外来抗原[1]。
由于它们在肿瘤中的选择性表达,由非同义突变和其他遗传改变产生的肿瘤特异性抗原(TSA)被称为新抗原。在具有病毒病因的人类肿瘤亚群中,如与默克尔细胞多瘤病毒(MCPyV)相关的默克尔细胞癌(MCC)以及与人类乳头瘤病毒(人乳头瘤病毒)相关的宫颈癌、口咽癌和其他部位癌,由病毒开放阅读框编码的蛋白质是另一种类型的新抗原。除了TSAs,还有两大类肿瘤抗原。肿瘤相关抗原(TAAs)在恶性细胞中过度表达,但在正常细胞中也以低水平表达。癌症/睾丸抗原(CTA)由各种肿瘤类型和生殖组织(例如睾丸、胎儿卵巢和滋养层)表达,但在成人的其他正常组织中表达有限,并且通常不存在于正常生殖细胞中,因为这些组织不表达MHC类分子。新抗原可以通过SNVs、碱基插入和基因融合在基因组水平上发生,通过选择性剪接、聚腺苷酸化(pA)、RNA编辑和所谓的非编码区在转录水平上发生,以及通过失调的翻译和蛋白质翻译后修饰在蛋白质组水平上发生。

▲肿瘤抗原的大类[1]
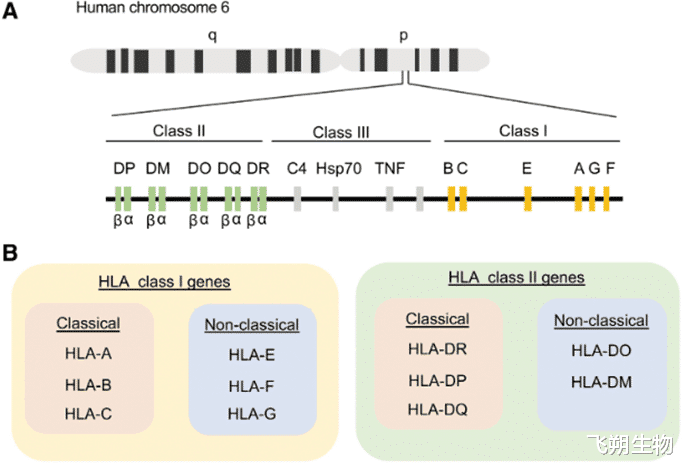
HLA的分类
T细胞的激活依赖于对外来肽片段和自身MHC分子的同时识别,这种现象称为MHC限制。CD8+t细胞受MHC-I和的限制,CD4+t细胞受到MHC-II的限制。主要组织相容性复合体(MHC),在人类中称为人类白细胞抗原(HLA),编码在人类基因组的6号染色体上。是一种非常多态的基因复合体,编码专门呈递和识别自身和非自身肽的细胞表面分子。HLA根据功能和结构分为三类:HLA-I,HLA-II,HLA-III。HLA类分子在有核细胞表面表达,但生殖系和一些神经元细胞除外。与HLA-I类分子相反,HLA-II类分子通常只存在于专职抗原呈递细胞(APCs) (B细胞、巨噬细胞、树突状细胞、朗格汉斯细胞)、胸腺上皮和活化(而非静止)T细胞上。HLA-III类分子的结构和功能还不清楚。它们不参与抗原结合,但参与炎症过程。
HLA进一步分为经典和非经典基因。经典HLA-I基因包括HLA-A、HLA-B和HLA-C,而非经典等位基因包括HLA-E、HLA-F和HLA-G。经典HLA-II基因包括HLA-DR、HLA-DP和HLA-DQ,而非经典等位基因包括HLA-DO和HLA-DM。人CD8+t细胞识别由经典HLA-A和HLA-B呈递的肽,并在较小程度上识别HLA-C。人类CD4+t细胞识别由HLA-DR、HLA-DQ和HLA-DP呈递的肽。HLA-I包含由三个胞外结构域(α1,α2,和α3)非共价连接到β2微球蛋白分子。HLA-II是一种异二聚体,由α和一个β链条组成。HLA的胞外域形成一个抗原结合裂缝,由围绕反平行-β折叠层的两个a-螺旋组成。这就产生了一个平台,可以容纳一个短的氨基酸(aa)片段,称为肽。这些肽通过特定氨基酸(称为锚定残基)与特定肽结合袋的相互作用结合到结合槽的底部。由于HLA-I结合裂缝的封闭结构,通常结合8-10个氨基酸的小肽。HLA-II可结合大于11个氨基酸的较长的肽。
▲成人弥漫性神经胶质瘤的分类[2]
新抗原的呈递
MHC-I蛋白呈递主要来源于细胞内的肽。在体内平衡期间,细胞蛋白质被蛋白酶体降解并产生小肽。蛋白酶体是一种多聚体蛋白质复合物,其将蛋白质降解成小肽片段。在病毒感染期间,干扰素的作用诱导形成一种替代的蛋白酶体复合物,称为免疫蛋白酶体,它增强了MHC-I呈递肽的生成。因此,当合成病毒蛋白质时,它们被免疫蛋白酶体靶向降解,要么作为完全折叠的蛋白质,要么作为有缺陷的核糖体产物。这导致产生来源于感染病毒的小肽片段,这些小肽片段可以被细胞质氨肽酶进一步修饰。然后,这些肽片段通过一种称为抗原加工相关转运蛋白(TAP)的蛋白质转运到内质网(er)中,这种蛋白质跨越ER膜,通过TAP易位后,任何对于MHC-I结合来说太长的肽都可以通过er驻留氨肽酶(ERAP1)进一步修饰。在ER中,空的MHC-I分子与肽装载复合物(PLC)相关,该复合物包括伴侣蛋白如Tapasin和Calnexin。PLC将空的MHC-I保持在肽接受构象中,当肽被TAP易位时,该构象促进肽的结合,TAP也是PLC的一部分。肽结合稳定了MHC-1蛋白,使其从内质网质量控制伴侣中释放出来,并通过高尔基体转运到细胞表面。这使得CD8+t细胞,以调查细胞内蛋白质组的感染或恶性肿瘤的迹象。然而,在树突细胞的特定亚群中,存在替代途径,这一过程被称为交叉呈递,涉及细胞外抗原的摄取、其从吞噬体到细胞质的反向转移,以及随后通过蛋白酶体和ER中的MHC-I负载的降解。

▲新抗原产生和呈递途径[3]
人类有超过24,000个不同的HLA-I (HLA-A、-B和-C)和HLA-II (HLA-DR、HLA-DQ和HLA-DP)等位基因,它们的混合导致多态性多样性。患者的HLA等位基因决定了其肿瘤特异性新抗原库,这些新抗原库将被呈递供T细胞识别。此外,HLA-LOH,发生在40%的非小细胞肺癌,损害了新抗原的呈递,促进了免疫逃避。因此,新抗原预测中最重要的初始步骤之一是确定患者的HLA基因型。现在可以用NGS数据应用几种计算方法来达到这个目的。
基于新抗原的治疗策略
由于缺乏胸腺选择和中枢耐受,由基因改变产生的肿瘤特异性新抗原引发高亲和力T细胞。基于其肿瘤特异性和免疫原性的优势,新抗原可以作为肿瘤免疫治疗的新兴靶点,包括肿瘤疫苗、act和基于抗体的治疗,以及ICBs的潜在预测因子[3]。

▲儿童弥漫性高级别胶质瘤分子特征[3]
新抗原由特异性针对每个患者的个性化新抗原或在许多癌症患者中表达的共有新抗原组成。基于公共新抗原的现成疗法比个体化新抗原疗法更节省资源和时间。因为个性化的新抗原是患者特异性的,它们不能用于靶向大量患者。随着高通量测序的最新进展,个性化的新抗原使得免疫系统能够在没有预定义的公共抗原的情况下适当地靶向恶性肿瘤上的免疫原性表位[4]。
TMB与TNB的关系
大多数黑色素瘤患者的TMB>10,能够产生更多有效的新生抗原。基于这些数据,可以预计:如果肿瘤中TMB>10,那么会产生比较多的新生抗原;如果肿瘤中1<tmb<10,< span="">仍然有可能携带新生抗原;如果肿瘤中TMB<1,通常很难产生可以被T细胞识别的新生抗原。TMB水平高(>10)的肿瘤患者,代表其肿瘤细胞表面的肿瘤新生抗原数量更多,免疫细胞能对肿瘤细胞产生更有效的杀伤作用,同时肿瘤患者能对免疫检查点抑制剂药物有更好的治疗响应。
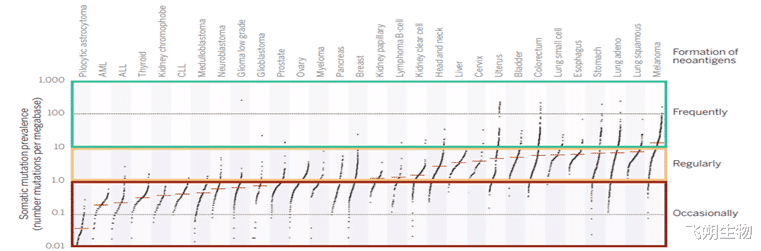
▲肿瘤TMB及产生新生抗原的可能性[4]
临床应用的挑战
1.基于新抗原的免疫疗法仅在少数记录良好的患者反应中显示出客观疗效。因此,需要相当大的改进来提高临床结果,包括增加新抗原预测的准确性、克服免疫逃避和优化生产过程的流水线。
2.新抗原预测的准确性有限:由于突变负荷的异质性和不同肿瘤类型之间显著不同的新抗原呈递,个体化免疫疗法的广泛应用受到靶向癌症新抗原的有限发现的限制。只有10%的非同义肿瘤细胞突变可以产生具有高MHC亲和力的突变肽,并且只有1%的MHC结合肽被患者T细胞识别。
3.新抗原的丢失:肿瘤特异性新抗原的缺失可能是肿瘤的一种重要免疫逃避策略,新抗原缺失可由多种途径诱导,如拷贝数丢失、转录抑制、表观遗传沉默和翻译后机制。
4.新抗原特异性T细胞产生不足:飞朔生物全景602基因检测产品包含HLA-I杂合性缺失检测,辅助免疫治疗获益评估。同时还包含靶向,化疗,TMB,TNB,免疫正负相因子等用药、分型、预后、遗传等相关信息,给予患者最大获益可能。
参考文献
1.Nat Rev Cancer. 2017 Apr;17(4):209-222.
2.Viral Immunol. 2020 Apr;33(3):160-178.
3.Signal Transduct Target Ther. 2023 Jan 6;8(1):9.
4.Science. 2015 Apr 3;348(6230):69-74.
声明:本文仅用于分享,如涉及版权等问题,请尽快联系我们,我们第一时间更正,谢谢!
