
自市场监督管理总局发布《在产在售“双无”保健食品集中换证审查要点》及配套政策以来,全国各地陆续出台了有关“双无”换证的细化方案,热度持续升温。
尽管为了规范行业管理,统一监管标准并推动行业的高质量发展,“双无”换证势在必行,但面对复杂繁琐的换证程序和诸多细致入微的严格要求,许多人都在一开始就犯了难。
那么,大健康食品企业应该以什么为抓手在过渡期内(2023.8-2028.8)稳步推进换证工作呢?
01 要争先“恐”后
1月初,贵州省市场监管局发布双无换证实施方案,其中特别强调在2025年12月31日前,完成对省内在产在售“双无”保健食品换证辅导的全覆盖;在新疆市场监管局2月10日发布的方案细则中,要求“相关企业加强学习,提前做好工作规划,避免在过渡期后期出现扎堆申报,影响换证工作”的表述被放置在了开篇处。
根据我们的不完全梳理,在各地近期陆续发布的实施方案中,几乎都存在类似的提示有关企业合理规划时间,规避潜在风险的表述。
什么是潜在风险?我们认为首先便是对换证流程时间的把控是否合理。
当前“双无”产品合计多达七千余个,涉及企业近五千家,所产生的问题更是包罗几乎各个方面:
配方不完整:部分产品辅料品种、用量不全,原辅料来源不明确;原辅料无适用标准,未提供质量标准及制备工艺。
生产工艺:缺乏关键工艺参数;同一产品包含多个剂型(形态)
原料:无使用依据或中药用量偏大,未提供安全性评价资料;有的原料为中药经酸、碱水解或发酵,物质基础发生重大改变,未按保健食品新原料进行安全性评价;使用品种为《国家畜禽遗传资源品种目录》的禁用野生动物等。
保健功能声称:未列入现行2023版功能目录;原功能学试验评价依据为原卫生部发布《保健食品功能学评价程序和检验方法(1996年版)》。
批文持有情况:同一产品注册证书涉及多个注册人;注册人为自然人,非法人。
生产销售情况:产品未获生产许可,未生产销售;或企业持产品批件副本生产。
申请人主体资质、信用情况异常(包括已注销、吊销、行政处罚等)
此外,换证程序的各个项目阶段所耗费的时间多以月为单位进行计算,若是产品涉及对功能试验的补充,单项指标的时间成本更长达半年至一年。因此,即便是整个换证流程的各项环节都顺利进行,也需要花费16-25个月之久。
因此,尽管官方给出的双无换证过渡期长达5年,但如果细心算下这笔时间账,就会发现它远不如看上去那样富余。对于“双无”保健食品,特别是非在产在售产品而言,换证工作的开展都宜早不宜晚。
02 梳理产品清单,强化证据链条
“双无”换证涉及多种情况:安全性评价;保健功能试验;卫生学、稳定性试验;产品配方调整;保健食品功能声称调整;人群食用安全性评价调查及研究的基础上修改产品技术要求等。要实现各环节的有序开展,企业首先便要对产品清单进行全面梳理,精准识别“双无”产品,避免遗漏或误判。
根据政策定义,“双无”产品特指2005年7月1日前由原卫生部或原国家食药监局批准但未载明有效期和技术要求的保健食品。企业需对所有在产在售产品进行排查,并着重注意以下几点是否符合现行规范要求:
① 批文持有情况:企业、共同持有、自然人
② 批文时间:1996年-2005年
③ 批文保健功能声称:抗氧化/血脂/记忆//免疫/缺氧/辐射/疲劳//减肥
④ 有无生产销售(SC证,企业标准)
⑤ 有无产品全套申报资料、证书(正本/副本)等
⑥ 上市后客户反馈/投诉记录、产品上市后调研
⑦ 产品在配方、指标、工艺有无自身完善修改过的地方(与批件相比)
一旦明确好换证范围,便可以开始着手准备换证流程的材料,并依据《审查要点》完善技术文件,强化证据链的支撑。
比如在配方与工艺的合规性验证方面,企业需要确保产品的配方用量、原料种类符合现行的《保健食品原料目录(2023年版)》等标准。若原料用量超标,需补充长期食用安全性论证报告或调整产品配方。
又或者在功能声称的重新论证方面,如果产品原功能声称不在2023版目录内(如原版“延缓衰老”调整为现行的“抗氧化”),就需要按新规提交功能验证试验(补充人体试食试验)。
根据我们的梳理,新旧保健功能声称涉及换证重新开展功能学试验项目的共有8类:
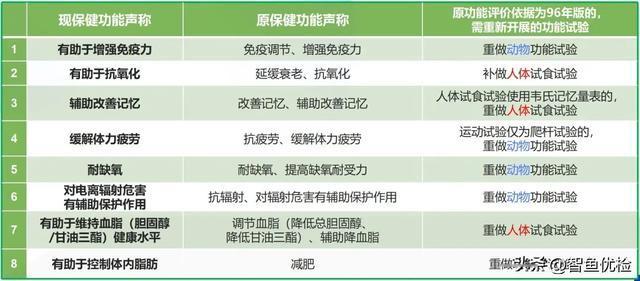
图源环特生物
“双无”换证政策之所以备受关注,正是由于它既是挑战,也是机遇。它不仅是单一的合规要求,更让相关企业得以借此机会优化产品结构,提升技术水平,从而实现自身生产能力和生产水平的全面进化,以此提升核心的竞争力。
如今,环特生物依托多维生物技术平台的服务积累,为大健康食品企业搭建了成熟的“双无”换证全案服务体系,助力企业实现换证效率与证据链条巩固的双向奔赴。我们相信,随着行业监管的持续完善,能够主动适应并积极拥抱政策变化的企业将在市场竞争中占据毋庸置疑的先机。
