
期刊:Nature
链接:
https://www.nature.com/articles/s41586-024-08532-4
https://www.nature.com/articles/s41586-024-08533-3
01
成果简介
2025年2月12日,美国华盛顿大学郑宁教授课题组与哈佛大学Brian B. Liau课题组合作,在Nature上背靠背再次发表了两篇关于UM171分子胶的重要研究。


研究首次解析了UM171作为分子胶的作用机制,提出了“双分子胶”的新概念,揭示了KBTBD4癌症突变通过直接结合组蛋白去乙酰化酶HDAC1/2驱动CoREST降解的分子机制并揭示了其与化学分子胶作用机制的相似性。不仅为解决分子胶理性设计的瓶颈问题提供了全新思路,也为开发新的癌症治疗策略奠定了重要基础。
02
背景介绍
造血干细胞(HSC)的体外扩增是细胞治疗的关键,而UM171作为强效的HSC自我更新激动剂,通过诱导CoREST辅阻遏复合物的降解发挥作用。早期研究发现,UM171通过招募CRL3泛素连接酶的底物受体KBTBD4,促进LSD1-CoREST复合物的泛素化降解,但其直接靶点和分子机制尚未完全阐明。分子胶是一类诱导E3泛素连接酶与底物结合的小分子,但其作用模式及E3偏好性仍不明确。
与此同时,KBTBD4作为CRL3复合体的底物受体,其热点突变在儿童髓母细胞瘤(Medulloblastoma, MB)中高频发生。这些突变赋予KBTBD4“新形态功能”,导致CoREST的异常降解,但其分子机制以及与UM171作用的关联性尚不清楚。
03
图文概览

图1. UM171诱导CoREST降解依赖HDAC1/2相互作用
a:UM171的化学结构;
b:全蛋白质组分析显示UM171处理显著降低CoREST和LSD1水平;
c-d:UM171快速诱导CoREST泛素化并降解;
e-h:CoREST的ELM2结构域和HDAC1/2结合位点是UM171作用的关键。

图2. HDAC1介导LHC–UM171–KBTBD4三元复合物形成
a-b:敲除HDAC1/2(而非LSD1)可阻断UM171诱导的CoREST降解;
e:HDAC抑制剂SAHA抑制UM171功能;
h:TR-FRET实验验证UM171促进KBTBD4与LHC复合物的结合。

图3. KBTBD4–UM171–LHC复合物的冷冻电镜结构
a:复合物整体结构显示UM171(黄色)和InsP₆(红色)作为双分子胶;
d:KBTBD4的KELCH重复螺旋桨结构域与HDAC1活性位点边缘结合。

图4. UM171和InsP₆的分子胶作用界面
d:UM171插入HDAC1活性口袋,与KBTBD4-B形成互补界面;
f:InsP₆桥接HDAC1、CoREST和KBTBD4-B的相互作用。

图5. 基因编辑扫描验证复合物功能界面
b-c:HDAC1的UM171结合位点突变显著影响CoREST降解。
e-f:KBTBD4的界面残基突变破坏复合物稳定性。

图6. KBTBD4突变促进CoREST降解
髓母细胞瘤PDX模型显示,KBTBD4-PR突变通过CRL3复合体介导CoREST和LSD1的泛素化降解,且依赖HDAC1/2的存在。
体外泛素化实验证实突变型KBTBD4增强对LHC复合体的结合和CoREST的泛素化修饰。

图7. 2b-2c环的深度突变扫描
双氨基酸插入突变(如PR311delinsPRR)显著增强CoREST降解能力,揭示了突变对界面形状互补的关键作用。

图8
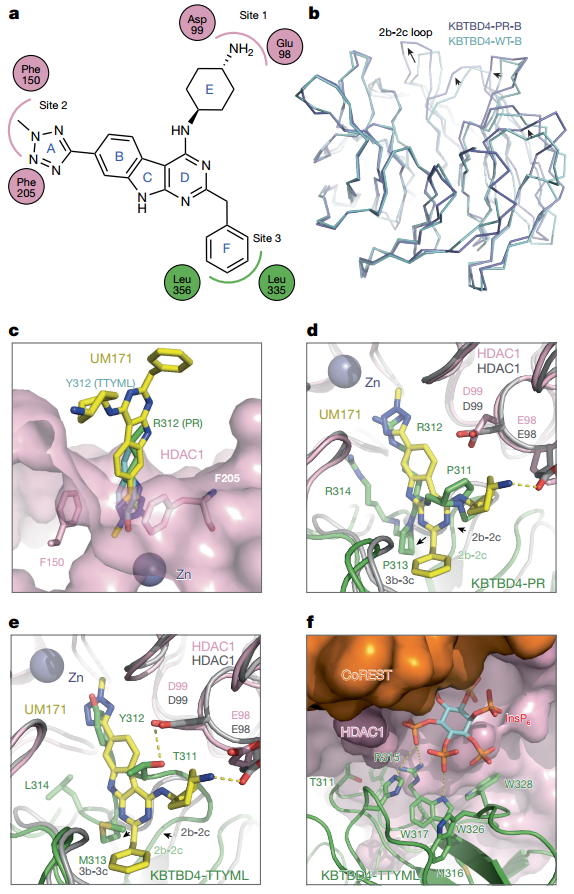
图9
图8、图9. 冷冻电镜结构揭示突变与UM171的趋同机制
KBTBD4-PR和TTYML突变体的2b-2c环插入HDAC1催化口袋,形成稳定的疏水和电荷相互作用(图7)。
UM171通过三个功能基团模拟突变的作用,占据HDAC1口袋的相同位点(图8),验证了“分子胶与基因突变趋同”的创新机制。

图10. HDAC抑制剂阻断突变体功能
HDAC1/2选择性抑制剂(如RBC1HI)可抑制KBTBD4突变型细胞的增殖,为靶向治疗提供了潜在策略。
04
结果讨论
研究通过整合冷冻电镜、功能蛋白质组学和基因编辑技术,系统揭示了UM171的分子胶机制及其与KBTBD4癌 症突变的趋同性。这不仅深化了对蛋白质相互作用重编程的理解,还为开发靶向降解疗法奠定了理论基础。未来研究可进一步探索其他新形态突变的分子机制,并基于趋同策略设计新型小分子胶水或抑制剂,拓展癌症治疗的新范式。
