编者按:功能性治愈可最大程度降低慢乙肝(CHB)患者的肝癌和远期不良结局的发生风险,目前已成为国内外慢乙肝防治指南公认的理想治疗目标,如何基于现有抗病毒药物更好地追求功能性治愈成为现领域的研究热点。近期,南京大学医学院附属鼓楼医院李婕教授作题为《聚焦前沿信息——为实现慢性乙肝的功能性治愈做准备》的精彩报告,本刊特将报告内容整理如下。
2015年我国《慢性乙型肝炎防治指南》首次提出将功能性治愈作为慢乙肝患者治疗的目标,2022年发布的最新指南也明确强调,对于部分适合条件的慢性乙肝患者,应追求功能性治愈。所谓功能性治愈,即停止治疗后乙肝表面抗原(HBsAg)持续阴性,伴或不伴乙肝表面抗体(抗-HBs)出现,HBV DNA低于最低检测下限,肝脏生物化学指标正常,其旨在最大限度地长期抑制HBV复制,减轻肝细胞炎症坏死及肝脏纤维组织增生,延缓和减少肝功能衰竭、肝硬化失代偿、肝细胞癌(HCC)和其他并发症的发生,改善患者生活质量,延长其生存时间。
01 HBsAg清除可明显降低慢乙肝患者HCC及终末期肝病的发生风险中国台湾地区的一项研究从两个医疗中心和REVEAL-HBV队列中招募了接受核苷(酸)类似物(NAs)治疗获得病毒学抑制的慢乙肝肝硬化患者(病毒抑制组,n=805)和获得HBsAg清除的慢乙肝肝硬化患者(HBsAg清除组,n=165),比较两组患者的HCC累积发生率。通过倾向评分匹配(PSM)分析,HBsAg清除组的肝癌年发生率仅为0.46%,远低于病毒抑制组的3.2%,且差异具有统计学意义(P=0.0035)(图1),这一发现强调了HBsAg清除在预防HCC中的关键作用。

图1. HBsAg清除组的肝癌发生率显著低于达到病毒抑制组 (源自讲者幻灯)
2023年一项荟萃研究共纳入50354名患者,随访350734人年,评估HBsAg清除和长期临床结局之间的关系。结果显示,HBsAg清除不仅显著降低了HCC风险,还大幅减少了肝硬化(风险降低72%,IRR:0.28)、肝细胞癌(风险降低73%,IRR:0.27)及肝病相关死亡率(风险降低83%,IRR:0.17)(图2)。

图2. HBsAg清除患者相比未清除患者终末期肝病发生风险显著降低 (源自讲者幻灯)
02 现有治疗方案的功能性治愈疗效评价中国台湾一项大型研究共纳入1075例应用NAs治疗的HBeAg阴性患者,5例患者于治疗期间获得HBsAg清除,691例患者根据亚太地区指南标准停用NAs,中位随访155周,42例患者发生HBsAg清除。研究者应用COX回归分析比较了治疗结束后HBsAg血清清除和未清除患者的基线和治疗中的临床和病毒特征、治疗时间、巩固时间、HBV DNA检测不到的时间、ALT复常的时间、治疗结束时HBsAg水平和HBsAg对数下降水平等。其结果表明, 治疗期间的HBsAg下降更多(>1 log10 IU/mL)是发生HBsAg清除的预测因素(HR 2.34,95%CI:1.2~4.57,P=0.0126)(表1)。

表1. HBsAg血清清除相关预测因素的Cox回归分析(源自讲者幻灯)
因此,以HBsAg下降水平或HBsAg清除率为评价指标,李婕教授归纳总结了单用和(或)联用各类NAs[包括恩替卡韦(ETV)、替诺福韦酯(TDF)、丙酚替诺福韦(TAF)、艾米替诺福韦(TMF)等]及干扰素-α(IFN-α)对CHB患者的临床治愈疗效,以期读者能就“凭借现有抗病毒药物如何更好实现功能性治愈”这一议题形成初步认识,具体结果如下:
一项回顾性研究纳入891例接受ETV(n=556)或TDF(n=335)治疗的无肝硬化CHB患者,所有患者在治疗后随访至少12个月(停药组);另外纳入677例HBeAg阳性(n=227)或HBeAg阴性(n=450)患者,继续接受ETV或TDF治疗至少4年(继续治疗组),旨在比较无肝硬化CHB患者ETV和TDF停药后HBsAg的清除率。结果显示,在停药组中,ETV组3、5、7年累积HBsAg清除率分别为7.7%、13.2%和22.6%,TDF组分别为12%、20.9%和35.4%;TDF组累积HBsAg清除率显著高于ETV组(P=0.019)。进一步通过倾向性评分匹配后,TDF组患者的HBsAg清除率依然显著高于ETV组,这一差异具有统计学意义(P=0.0015)(图3)。

图3. 不同NAs治疗的无肝硬化CHB患者停药后的HBsAg清除率比较 (源自讲者幻灯)
一项荟萃分析在Medline、Embase和Cochrane Library中系统检索了2023年11月之前接受ETV治疗的乙肝患者转用TDF治疗与继续ETV治疗的研究,最终纳入10项研究,共计1588例患者,其中TDF治疗患者569例,ETV治疗897例。主要结局包括HBsAg消失、水平降低和完全病毒学应答(CVR),次要结局包括ALT水平相对于基线的平均变化、HBeAg血清学转换率及HBeAg清除。结果表明,TDF降低HBsAg水平的作用优于ETV(MD=0.04 IU/mL,95%CI:0.02~0.05,P<0.00001)(图4)。

图4. TDF降低HBsAg水平的作用优于ETV (源自讲者幻灯)
另一项研究表明,TDF可诱导IFN-λ3高表达,IFN-λ可激活JAK-SATA-ISRE信号通路,刺激ISGs如MX1、OAS、IFR7等的表达增加,进一步抑制HBsAg产生(图5)。该研究为CHB的治疗提供了新的视角和策略。

图5. TDF治疗CHB的机制和效果
A:TDF治疗CHB HBV DNA下降的同时伴有IFN-λ3表达增加;B:重组IFN-λ3抑制HBsAg呈剂量依赖性;C:对比ETV,阿德福韦酯(ADV)明显上调MX1和OAS2, 从而抑制HBsAg产生
(源自讲者幻灯)
一项多中心、随机对照研究纳入240例HBeAg阴性患者接受48周PEG-IFNα-2a治疗(180 μg/周)±拉米夫定(LAM,100 mg/天),对纳入长期随访研究的患者(n=230)进行5年疗效分析。结果显示,HBsAg清除率在停药随访24周时为3%,停药随访至3年时增加至8.7%,停药5年增加至12%(图6),表明加用干扰素治疗的HBsAg清除率略高,但仍不理想。

图6. 停药后随访的HBsAg清除率 (源自讲者幻灯)
李婕教授坦言,NAs联合PEG-IFN治疗是现行治疗方法中无奈的选择。一项开放标签研究纳入740例CHB患者,随机分配接受TDF+PEG-IFN初始联合治疗48周(A组)、TDF+PEG-IFN治疗16周后TDF治疗32周(B组)、TDF治疗120周(C组),PEG-IFN治疗48周(D组),于第120周评估疗效和安全性。结果显示,在第120周时,A组HBsAg清除率最高,为10.4%,显著高于C组(0%,P<0.001)、B组和D组(均为3.5%,P=0.002)(图7);A组患者的HBsAg下降幅度最大,达到2.4 log10 IU/mL,显著高于B、C和D组(P值均<0.001)(图8)。

图7. TDF和PEG- IFN单药或联合治疗120周的HBsAg清除率(K-M分析) (源自讲者幻灯)

图8. TDF和PEG- IFN单药或联合治疗120周HBsAg水平的变化(K-M分析) (源自讲者幻灯)
另有一项研究将纳入的患者随机分配至PEG-IFNα-2b+ETV组或PEG-IFNα-2b+TDF组,治疗周期为48周。结果显示,治疗48周时,与PEG-IFNα-2b+ETV组相比,PEG-IFNα-2b+TDF组HBsAg下降幅度更大(-1.799±0.3063 vs. -1.078±0.2028 log10 IU/mL,P=0.0491)(图9)。

图9. 相较加用ETV,PEG-IFNα-2b加用TDF后HBsAg下降幅度更大,HBeAg清除率更高 (源自讲者幻灯)
综合上述各研究结论可知,NAs单药治疗中,TDF的HBsAg清除率最高,为3%~11%,ETV次之(1.4%~5.1%),而TAF仅为1%;IFN单药治疗的HBsAg清除率则在3%~7%。此外,NAs与干扰素的联合治疗方案显示出更高的HBsAg清除率,初始联合为8%,换用和加用方案分别为14%和8%。与此同时,李婕教授表示,上述研究提及的联合方案并不具备普适性,在面对不同的CHB患者时,应基于其自身的HBsAg动态变化制订个体化治疗决策;此外,药物联合或前后序贯治疗对于清除HBsAg的效果仍然有限,国内外指南均不优先推荐干扰素联合NAs药物的治疗策略,我们应在不断优化现有抗病毒治疗方案的同时,继续探索抗乙肝新药,争取早日实现CHB患者的功能性治愈。
此外,李婕教授指出,现有治疗方案惠及的患者人群有限。“绿洲项目”开启2.5年的阶段性数据表明,针对HBsAg水平低于1500 IU/mL的患者,部分患者获得了一定程度的改善。“珠峰项目”则进一步聚焦于基线HBsAg水平更低的患者,开启5年后的阶段性数据表明HBsAg水平越低,清除率越高。而“赢领项目”则计划纳入HBsAg水平低于500 IU/mL的患者,以期获得更好的治疗效果。
03 功能性治愈新药的探索与展望李婕教授介绍,当前正在探索中的慢乙肝功能性治愈药物分为病毒靶向药物和免疫调节药物两类。病毒靶向药物通过精准打击病毒生命周期的关键环节,如吸附、进入、脱壳、逆转录及整合等,有效抑制病毒复制;免疫调节药物则侧重于激活并增强宿主的免疫系统,以更高效地清除病毒(图10)。
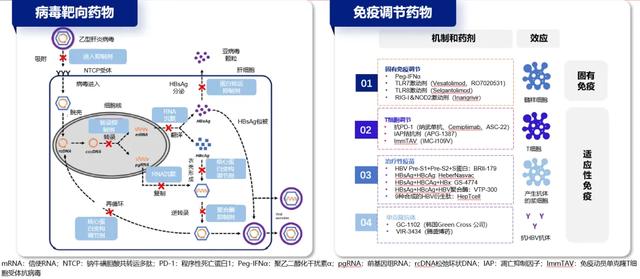
图10. 病毒靶向药物和免疫调节药物的机制 (源自讲者幻灯)
当前实现功能性治愈的多种可能方案聚焦于三大核心策略:抑制复制、降低抗原及刺激免疫。抑制复制的药物主要包括NAs、衣壳组装调节剂(CAM)、核酸聚合物(NAPs);降低抗原的药物主要包括小干扰RNA(siRNA)和反义寡核苷酸(ASO);刺激免疫的药物主要包括PEG-IFN、TLR7/8激动剂、抗-PD-1(PD-L1)抗体以及治疗性疫苗。
李婕教授特别指出,小核酸药物(siRNA和ASO)在降低HBsAg方面具有前景,是慢乙肝新药研发的热点。小核酸药物可发挥RNA干扰作用,精准靶向HBV的mRNA和pgRNA,有效减少HBV抗原的生成和病毒的复制(图11)。目前正在研发中的小核酸药物已进入Ⅰ、Ⅱ、Ⅲ期临床,这些药物均展示了通过降低HBsAg水平来治疗慢乙肝的巨大潜力。

图11. 小核酸药物的作用机制 (源自讲者幻灯)
李婕教授阐述了乙肝未来可能的治疗策略,旨在实现功能性乃至完全治愈。策略分为四大核心部分:(1)病毒复制的有效抑制:通过干预乙肝病毒的复制周期,包括阻止其侵入细胞、mRNA转录、病毒衣壳装配及病毒蛋白的分泌,同时加强对cccDNA(共价闭合环状DNA)的控制,为后续的免疫治疗奠定坚实基础;(2)病毒抗原抑制剂的应用:利用此类抑制剂激活或恢复机体对HBV的特异性免疫反应,从而实现对病毒的有效控制,是免疫重建的关键步骤;(3)免疫调节的强化:通过调节免疫应答,不仅沉默或清除cccDNA,还确保免疫系统的平衡与高效,进一步巩固对病毒的免疫控制;(4)cccDNA抑制剂的研发:直接针对cccDNA这一病毒持续存在的根源,通过抑制或清除cccDNA,为乙肝的彻底治愈开辟新途径。
总 结李婕教授指出:功能性治愈是慢乙肝的治疗目标,实现HBsAg清除后持久应答可显著降低CHB患者HCC、终末期肝病等不良事件的发生风险;就当下CHB患者的治疗方案而言,单独使用NAs或IFN的临床收益并不理想,亟需优化现有的抗病毒治疗方案,为实现功能性治愈提供更多选择;同时,新型抗乙肝药物的研发亦迫在眉睫,诸多在研新药已在功能性治愈CHB患者中表现出极大的治疗潜力,抗乙肝新药研发未来可期。
