
聚焦细菌群体感应与生物膜核心领域,系统剖析其前沿进展与深层内涵。于群体感应机制层面,革兰氏阴性菌 AHL 经 LuxI 酶促合成、跨膜扩散,与 LuxR 协作激活基因表达;革兰氏阳性菌 AIP 多步合成转运,借激酶 - 调节蛋白级联响应;AI - 2 为通用信号,其合成、转运、识别机制精妙独特,协同塑造细菌群体行为范式。
群体感应功能多元,协调生物发光、毒力表达等群体行为,驱动生物膜从初始附着、EPS 合成至成熟动态调控全程,为细菌生存繁衍精巧布局。与宿主互作复杂,其分子可破坏屏障、激炎致癌,宿主亦分泌模拟物、利用自身分子或脂肪酸反击,攻防间左右健康与疾病天平。
疾病情境中,病原菌群体感应与生物膜狼狈为奸,铜绿假单胞菌凭此致慢性感染,然天然与合成抑制剂、益生菌可靶向干扰群体感应,扭转疾病战局。前沿研究借多组学技术深度解密机制,临床视群体感应分子为诊断标记与治疗靶点革新医疗,环境与工业领域更挖掘其修复污染、优化加工、保鲜防治潜能,跨界驱动创新。此领域研究持续拓展深化,为健康、生态、产业多领域变革注入源头活力,开辟广阔前景,引领跨学科融合迈向崭新高度,是细菌学、医学、生态学与生物技术交叉创新的关键前沿阵地,蕴藏无限发展可能与深远影响力。
 一、引言
一、引言细菌作为地球上最为古老且数量庞大的生命形式之一,在其复杂的生存与繁衍历程中,发展出了精妙绝伦的群体感应(Quorum Sensing,QS)机制及生物膜形成能力。群体感应宛如细菌间的隐形桥梁,使其能够依据种群密度精准调控基因表达,协同完成诸如毒力释放、生物膜构建等复杂群体行为;生物膜则为细菌构筑起坚固堡垒,显著提升其环境适应力与耐药性,二者紧密交织,深刻塑造细菌的生态格局,对人类健康、工业生产、环境保护等诸多领域产生深远影响。深入探究细菌群体感应与生物膜,恰似解锁微观世界奥秘的关键钥匙,不仅有助于揭示细菌致病机制、创新抗菌策略,更能为生物工程、生态修复等前沿领域注入革新动力,引领跨学科研究迈向全新征程。
二、群体感应的分子机制(一)信号分子类型及合成途径AHL(酰基高丝氨酸内酯)介导的革兰氏阴性菌群体感应:革兰氏阴性菌中,AHL 信号分子借 LuxI 型合成酶催化,以酰基 - 酰基载体蛋白(acyl - ACP)和 S - 腺苷甲硫氨酸(SAM)为底物经多步反应合成。其结构通式为酰基链连接高丝氨酸内酯环,酰基链长度与取代基差异赋予信号特异性,如铜绿假单胞菌产生的 N -(3 - 氧代十二烷酰基) - L - 高丝氨酸内酯(3 - oxo - C12 - HSL)和 N - 丁基 - L - 高丝氨酸内酯(C4 - HSL),前者参与调控众多毒力基因表达。AHL 可依浓度梯度自由扩散穿越细菌细胞膜,此特性为其在群体感应中高效传递信息奠定基础。自诱导肽(AIP)调控的革兰氏阳性菌群体感应:革兰氏阳性菌的 AIP 合成起始于核糖体,以前体肽形式诞生后,历经翻译后修饰与加工成熟,再经特定转运系统主动跨膜输出。AIP 序列短(常 5 - 20 氨基酸残基)、结构多样且具种属特异性,如金黄色葡萄球菌 Agr 系统产生的 AIP,借 AgrC 受体激酶识别结合,触发 AgrA 响应调节蛋白磷酸化,启动毒力基因转录级联反应,主宰细菌毒力因子分泌、生物膜动态变化及宿主细胞侵袭能力。AI - 2:细菌世界的通用 “语言”:AI - 2 分子独特之处在于其于革兰氏阴性菌与阳性菌皆有踪迹,以 LuxS 蛋白为合成关键,底物经系列酶促反应转化为 AI - 2 前体,修饰成熟后借助转运蛋白跨膜穿梭。尽管 AI - 2 为通用信号分子,但仅被含对应受体(如 Lsr 系统)细菌识别响应,于哈维氏弧菌驱动生物发光、大肠杆菌调节生物膜架构与代谢程序等生理进程中发挥核心枢纽效能,恰似细菌跨物种交流的隐秘暗号。 (二)信号检测与响应机制
(二)信号检测与响应机制细菌细胞膜镶嵌的受体蛋白是感知群体感应信号分子的前哨站。以 LuxR 蛋白家族为例,其胞外域捕获 AHL 分子后引发构象重塑,激活胞内域与 DNA 结合活性,精确锚定于靶基因启动子区域的特定序列(“lux box”),招募 RNA 聚合酶起始转录;AIP 受体激酶激活后借磷酸化接力激活胞内反应调节蛋白,精准调控靶基因表达节奏;含 AI - 2 受体细菌中,Lsr 系统介导 AI - 2 摄取与信号转导,内化的 AI - 2 磷酸化修饰后解锁级联反应,重塑细菌代谢、运动、生物膜等行为模式。此等信号检测与响应机制丝丝入扣,确保细菌群体行为精准契合环境与种群需求,于微观世界书写生存智慧篇章。
 三、群体感应在细菌生态中的功能(一)协调群体行为生物发光现象的调控:海洋发光细菌费氏弧菌(Vibrio fischeri)为典范,于海洋环境中,低密度时 LuxI 合成少量 3 - oxo - C6 - HSL,随种群繁衍浓度攀升,AHL 与 LuxR 结合激活 lux 操纵子转录,驱动荧光素酶合成,当达阈值,群体同步发光,在深海黑暗中吸引宿主、构建共生关系或驱避捕食者,借群体感应光辉点亮生存机遇。毒力因子的协同表达:诸多病原菌如铜绿假单胞菌、金黄色葡萄球菌,依群体感应指挥棒,于感染宿主时依种群密度适时释放蛋白酶、溶血素、绿脓菌素等毒力因子。铜绿假单胞菌 LasI/LasR 和 RhlI/RhlR 系统调控毒力基因,低密度时蛰伏,高密度时协同激活毒力表达,强力侵袭宿主组织、瓦解免疫防线、引发严重感染病症,群体感应为其致病策略注入狡黠智慧。(二)生物膜形成中的关键作用
三、群体感应在细菌生态中的功能(一)协调群体行为生物发光现象的调控:海洋发光细菌费氏弧菌(Vibrio fischeri)为典范,于海洋环境中,低密度时 LuxI 合成少量 3 - oxo - C6 - HSL,随种群繁衍浓度攀升,AHL 与 LuxR 结合激活 lux 操纵子转录,驱动荧光素酶合成,当达阈值,群体同步发光,在深海黑暗中吸引宿主、构建共生关系或驱避捕食者,借群体感应光辉点亮生存机遇。毒力因子的协同表达:诸多病原菌如铜绿假单胞菌、金黄色葡萄球菌,依群体感应指挥棒,于感染宿主时依种群密度适时释放蛋白酶、溶血素、绿脓菌素等毒力因子。铜绿假单胞菌 LasI/LasR 和 RhlI/RhlR 系统调控毒力基因,低密度时蛰伏,高密度时协同激活毒力表达,强力侵袭宿主组织、瓦解免疫防线、引发严重感染病症,群体感应为其致病策略注入狡黠智慧。(二)生物膜形成中的关键作用生物膜初始构建阶段,浮游细菌借群体感应评估环境适宜度与种群规模,达阈值后启动附着程序,借鞭毛、菌毛、粘附素等表面结构锚定宿主或物体表面;EPS 合成与分泌为生物膜成熟关键,群体感应激活合成酶基因转录,调控多糖、蛋白质、核酸等成分协调组装成 EPS 基质,增强生物膜结构稳定性、抗逆性与细胞间联系;成熟生物膜内细菌借群体感应持续交流,依环境与种群需求动态优化代谢分工、基因表达与空间布局,调控细胞从生物膜脱离、迁移、再定植,拓展生存疆域、维系群落延续,群体感应为生物膜从萌芽至繁荣全程精心布局、精准导航。
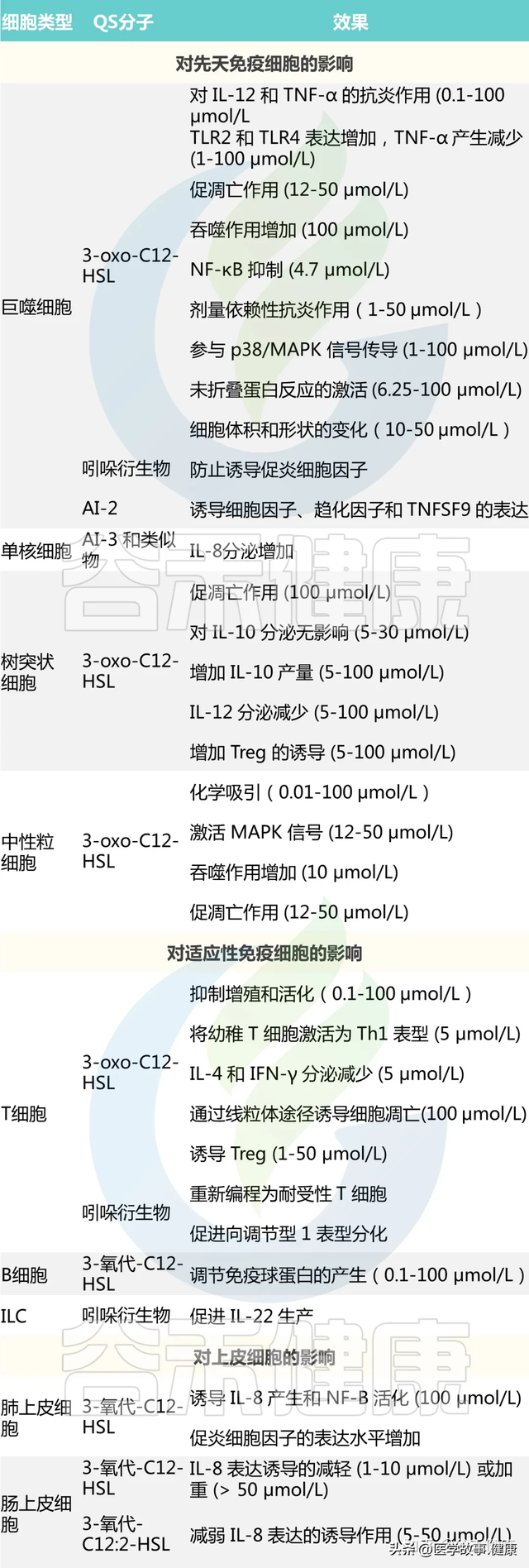
 四、群体感应与宿主相互作用(一)对宿主的影响屏障功能破坏:铜绿假单胞菌 3 - oxo - C12 - HSL 等群体感应分子侵袭肠道,靶向上皮细胞启动凋亡程序,破坏紧密连接蛋白网络致使肠屏障通透性剧增、粘蛋白分泌失序,为病原菌易位、内毒素扩散与炎症激发开辟通道;而部分分子如 3 - oxo - C12:2 - HSL 与吲哚衍生物可强化紧密连接、维护屏障完整,细菌群体感应分子于肠屏障功能塑造中扮演双刃剑角色,左右肠道稳态平衡。炎症反应激活:自诱导剂 AI - 2、AI - 3 分别诱导巨噬细胞表达 TNF - SF9、IL - 8 点燃炎症烽火,3 - oxo - C12:2 - HSL 抑制上皮细胞 IL - 8 分泌制衡炎症,群体感应分子于免疫细胞激活、炎症因子释放网络纵横捭阖,其在肠道炎症疾病进程中或推波助澜、或缓和修复,复杂作用受细菌种类、浓度、宿主免疫背景及环境因素交织影响。致癌风险提升:肠道菌群失调为大肠癌滋生温床,梭杆菌等借群体感应优势定植、促炎,营造肿瘤微环境;大肠癌细胞中 AI - 2 浓度随病情进展攀升,经 TNFSF9 通路极化巨噬细胞、重塑肿瘤免疫格局,细菌群体感应分子深度嵌入肿瘤起始、演进、免疫逃逸环节,为癌症防控带来全新挑战与靶点机遇,揭示癌症发病机制隐秘拼图一角。(二)宿主的反馈调节模拟信号分子分泌:肠上皮细胞应激下分泌 AI - 2 模拟物,干扰细菌群体感应通信网络,影响细菌粘附、毒力与生物膜进程;模拟物与上皮紧密连接损伤关联暗示宿主于细胞与分子层面主动抵御细菌侵袭策略,拓展宿主 - 细菌互作认知边界,为新型抗菌疗法设计提供仿生灵感。利用宿主分子信号:儿茶酚胺等宿主激素为细菌生长 “肥料”,经细菌 QseC 等受体激活群体感应通路;OCL 稳定细菌关键蛋白活性赋能群体感应,细菌巧借宿主分子信号反哺自身生长代谢与群体感应,揭示跨域分子对话在塑造共生 - 致病关系中的核心地位,启发微生态干预新视角与新策略,以靶向分子对话重塑健康菌群生态。脂肪酸的抑制作用:脂肪酸化学结构近似细菌群体感应信号分子,干扰 AHL、AI - 2 信号转导抑制生物膜与毒力基因表达,为宿主化学屏障关键组分;胆汁脂肪酸模拟信号调控生物膜,为小肠抵御病原体构筑防线,宿主脂肪酸天然抗菌活性为抗菌药物研发点亮曙光,指引从内源性分子挖掘抗菌宝藏新航向。
四、群体感应与宿主相互作用(一)对宿主的影响屏障功能破坏:铜绿假单胞菌 3 - oxo - C12 - HSL 等群体感应分子侵袭肠道,靶向上皮细胞启动凋亡程序,破坏紧密连接蛋白网络致使肠屏障通透性剧增、粘蛋白分泌失序,为病原菌易位、内毒素扩散与炎症激发开辟通道;而部分分子如 3 - oxo - C12:2 - HSL 与吲哚衍生物可强化紧密连接、维护屏障完整,细菌群体感应分子于肠屏障功能塑造中扮演双刃剑角色,左右肠道稳态平衡。炎症反应激活:自诱导剂 AI - 2、AI - 3 分别诱导巨噬细胞表达 TNF - SF9、IL - 8 点燃炎症烽火,3 - oxo - C12:2 - HSL 抑制上皮细胞 IL - 8 分泌制衡炎症,群体感应分子于免疫细胞激活、炎症因子释放网络纵横捭阖,其在肠道炎症疾病进程中或推波助澜、或缓和修复,复杂作用受细菌种类、浓度、宿主免疫背景及环境因素交织影响。致癌风险提升:肠道菌群失调为大肠癌滋生温床,梭杆菌等借群体感应优势定植、促炎,营造肿瘤微环境;大肠癌细胞中 AI - 2 浓度随病情进展攀升,经 TNFSF9 通路极化巨噬细胞、重塑肿瘤免疫格局,细菌群体感应分子深度嵌入肿瘤起始、演进、免疫逃逸环节,为癌症防控带来全新挑战与靶点机遇,揭示癌症发病机制隐秘拼图一角。(二)宿主的反馈调节模拟信号分子分泌:肠上皮细胞应激下分泌 AI - 2 模拟物,干扰细菌群体感应通信网络,影响细菌粘附、毒力与生物膜进程;模拟物与上皮紧密连接损伤关联暗示宿主于细胞与分子层面主动抵御细菌侵袭策略,拓展宿主 - 细菌互作认知边界,为新型抗菌疗法设计提供仿生灵感。利用宿主分子信号:儿茶酚胺等宿主激素为细菌生长 “肥料”,经细菌 QseC 等受体激活群体感应通路;OCL 稳定细菌关键蛋白活性赋能群体感应,细菌巧借宿主分子信号反哺自身生长代谢与群体感应,揭示跨域分子对话在塑造共生 - 致病关系中的核心地位,启发微生态干预新视角与新策略,以靶向分子对话重塑健康菌群生态。脂肪酸的抑制作用:脂肪酸化学结构近似细菌群体感应信号分子,干扰 AHL、AI - 2 信号转导抑制生物膜与毒力基因表达,为宿主化学屏障关键组分;胆汁脂肪酸模拟信号调控生物膜,为小肠抵御病原体构筑防线,宿主脂肪酸天然抗菌活性为抗菌药物研发点亮曙光,指引从内源性分子挖掘抗菌宝藏新航向。 五、群体感应在疾病中的角色及干预策略(一)在感染性疾病中的作用机制
五、群体感应在疾病中的角色及干预策略(一)在感染性疾病中的作用机制铜绿假单胞菌致肺部感染,群体感应系统调控毒力因子释放与生物膜生成。AHL 信号激活后驱动弹性蛋白酶裂解组织屏障、绿脓菌素损伤细胞、鼠李糖脂调控生物膜结构与功能,生物膜助细菌抵御免疫清除与抗菌药物杀伤,致慢性感染迁延不愈、炎症迁延反复,群体感应为细菌感染与免疫逃逸筑牢 “铜墙铁壁”,加剧病情复杂性与治疗棘手性。
(二)群体感应抑制剂的研发与应用天然产物来源抑制剂:植物源黄酮类(槲皮素、山柰酚、黄芩素)、苯甲酸衍生物(肉桂酸、没食子酸)、萜类(香芹酚、丁香酚、芳樟醇)等天然化合物借多靶点机制抑制群体感应。黄酮类阻断受体结合、萜类干扰信号合成或降解,部分于低微浓度显效,为抗菌药物拓展天然 “兵器库”;中药单体如黄连素、苦参碱抑制大肠杆菌群体感应与生物膜,且联合抗菌药协同增效、逆转耐药,为中药现代化抗菌研究开辟通途、注入活力。合成化合物抑制剂:设计合成模拟信号分子或靶向受体拮抗剂,如二酮哌嗪环类化合物竞争结合受体阻断信号传递,酶降解型抑制剂(酰化酶、乳糖酶类)分解信号分子釜底抽薪,二者协同增效降低细菌致病性、瓦解生物膜、提升抗菌药敏感性,为攻克耐药菌难题贡献合成智慧与创新方案,重塑抗菌治疗格局。 (三)益生菌对群体感应的干扰
(三)益生菌对群体感应的干扰双歧杆菌、乳酸杆菌等益生菌携 LuxS/AI - 2 系统,产 AI - 2 等信号分子调控自身与菌群行为、塑造生物膜优化肠道生态。双歧杆菌产乙酸抑制病原菌毒力、乳酸杆菌淬灭病原体群体感应、抑制生物膜与毒力因子生成,益生菌似肠道 “维和部队”,借群体感应竞争与制衡机制拮抗病原菌、加固肠道屏障、维持微生态和谐稳态,为防治肠道疾病提供绿色、天然微生态干预策略。
 六、群体感应与生物膜研究的前沿进展与展望(一)多组学技术解析机制
六、群体感应与生物膜研究的前沿进展与展望(一)多组学技术解析机制转录组学揭示群体感应基因表达全景图,挖掘新调控网络节点与通路;蛋白质组学刻画信号转导关键蛋白动态变化、解析生物膜 EPS 蛋白质组奥秘;代谢组学追踪群体感应代谢物指纹图谱、剖析生物膜代谢特征与营养策略;宏基因组学挖掘菌群群体感应基因多样性与功能潜力,多组学融合技术全方位、多层次、高精度剖析细菌群体感应与生物膜分子机制、生态功能及演化规律,为研究注入大数据驱动、系统生物学智慧,照亮微观世界隐藏角落。
(二)临床应用拓展精准医学时代,群体感应分子有望成疾病诊断生物标志物与治疗靶点。检测患者样本中特定信号分子预测疾病进程、评估预后;靶向群体感应开发新型抗菌药、抗生物膜药、免疫调节剂,为耐药菌感染、慢性炎症、癌症治疗开辟新径;设计群体感应智能响应材料,于伤口敷料、植入器械表面精准抗菌、防污,提升医疗设备生物相容性与服役寿命,推动群体感应研究成果从实验室跃向临床应用前沿阵地,变革医疗实践范式。
 (三)环境与工业领域应用潜力
(三)环境与工业领域应用潜力环境修复中,调控降解菌群体感应优化污染物代谢途径、加速降解效率,治理土壤、水体污染;工业生物加工借群体感应优化微生物发酵工艺,精准控制代谢产物合成、提升产量质量;食品保鲜借抑制腐败菌群体感应延长货架期、保障食品安全;生物防治中,工程益生菌借群体感应竞争定殖、分泌抗菌物质防控植物病害、减少农药依赖,群体感应技术跨界应用为生态环保、农业可持续发展与工业革新注入创新活力,塑造绿色发展新未来。



